摘要:亲和力测定可以帮助研究人员判断两个分子之间是否具有相互作用,以及这种作用的大致强度。表面等离子共振(Surface Plasmon Resonance, SPR)技术常被应用于亲和力测定,可以提供详细的动力学信息,具有高灵敏度、实时和无标记的突出优势。HBO1蛋白是多功能组蛋白酰基转移酶,与JADE或BRPF家族支架蛋白形成复合物催化组蛋白的乙酰化、丙酰化、丁酰化和巴豆酰化修饰。Xiao [1] 等的研究表明, HBO1催化结构域与BRPF2的N端片段形成的复合物(HBO1-BRPF2复合物)的活性反应中心可以分别结合乙酰辅酶A、丙酰辅酶A、丁酰辅酶A和巴豆酰辅酶A。本文详细介绍了利用SPR技术测定HBO1-BRPF2复合物与不同酰基辅酶A分子相互作用亲和力的实验过程。
关键词: 亲和力, SPR, HBO1-BRPF2, 酰基辅酶A (acyl-CoAs)
材料与试剂
- Sensor Chip CM5(Cytiva,货号:BR100530)
- 96孔板(Greiner,货号:650101)
- Microplate Foil 96-well(Cytiva,货号:28975816)
- HBS buffer(实验室配制)
- Acetate 5.0(Cytiva,货号:BR100351)
- Acetate 5.5(Cytiva,货号:BR100352)
- NaOH 50(Cytiva,货号:BR100358)
- Amine Coupling Kit(Cytiva,货号:BR100050)
- HBO1-BRPF2(原核表达,实验室亲和纯化。两种蛋白共表达时使用的是人源HBO1的催化结构域(氨基酸残基336–611)和BRPF2的N端片段(氨基酸残基31-80))
- CoA(Merck,货号:C4282)
- Ace-CoA(Merck,货号:A2181)
- Pro-CoA(Merck,货号:P5397)
- But-CoA(Merck,货号:B1508)
- Cro-CoA(Merck,货号:28007)
- Succ-COA(Merck,货号:S1129)
仪器设备
- Biacore 8K (Cytiva,货号:29337763)
- 微型台式真空泵(其林贝尔仪器制造有限公司,型号:GL-802A)
- BarnsteadTM GenPureTM Pro 水净化系统(Thermo Scientific,货号:50131952)
实验步骤
一、实验前的准备
- 配制1× HBS buffer(含10 mM HEPES (pH7.4) 和150 mM NaCl,充分混匀,0.22 μm滤膜过滤后作为本次实验的Running Buffer。Biacore 8K仪器每次实验准备2 L Running Buffer为宜。从2 L Running Buffer中预留出2 × 45 mL Running Buffer 置于干净无菌的50 mL离心管中,以备后续实验中分析物的稀释以及无样品通道上样孔补充体积所需。
- 关闭Biacore 8K仪器样品舱内蓝色光源,以免蓝光对样品造成不必要的活性干扰。
- 本次实验的系统温度为25 °C,检查仪器的温度设置是否正确。
- 从4 °C冰箱中取出一张CM5芯片,平衡至室温。将维护芯片换下,换上CM5芯片(图1, 2)。
- 将仪器右侧标记“Buffer”和“Reagent”管道放置在Running Buffer瓶中,标记“Water”管道放置在ddH2O瓶中。点击控制软件主界面第一列System setup中的Change Solutions,点击Ready to Start,重复3次,让仪器进行3次Change Solution,通过该操作清除仪器管路中残存的其它溶液,使仪器管道充分浸润在实验所需的Running Buffer环境中(图1, 3)。每次Change Solution操作需消耗约200 mL Running Buffer。
- 设置运行程序:Baseline Stabilization,使芯片表面8个通道充分浸润在Running Buffer环境中,同时将芯片表面可能存在的一些杂质洗掉。(图4)
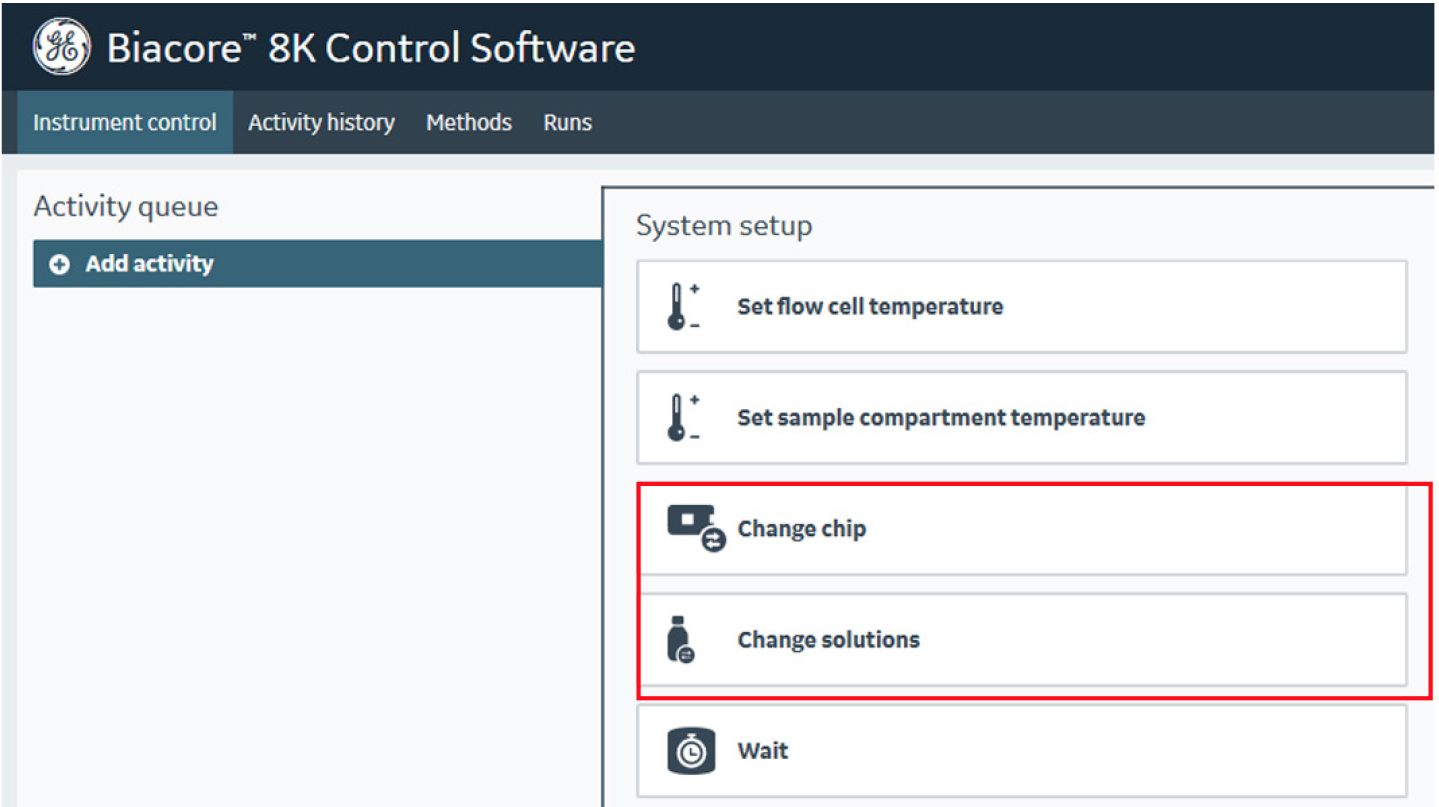
图1 点击“Change chip”可更换芯片;点击“Change solutions”可冲洗管路,以及置换管路中的运行溶液。
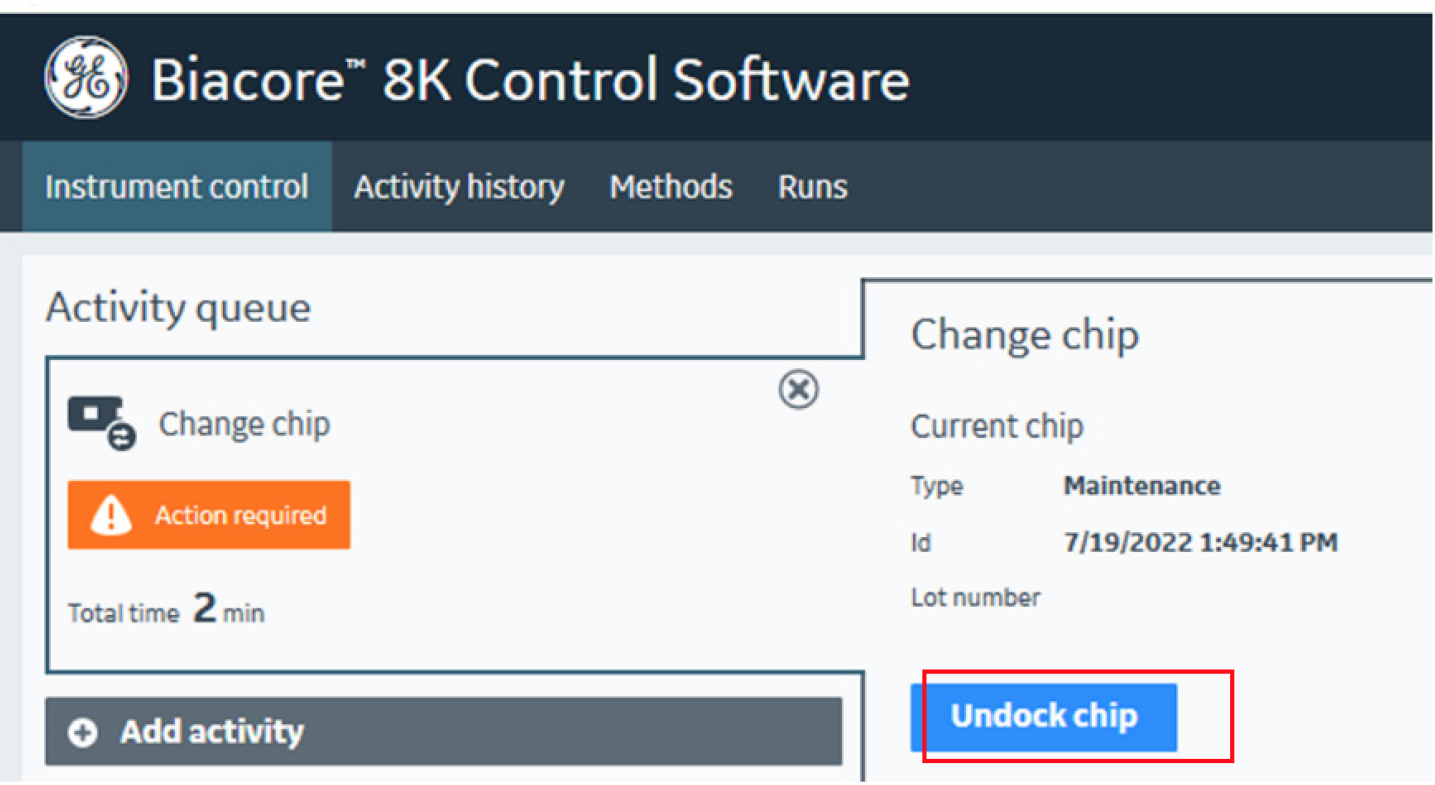
图2 点击“Undock chip”后维护芯片将被弹出,取出维护芯片,换上CM5 芯片,合上芯片舱的舱门。然后在软件界面选择“New chip”,在Type的下拉菜单中选择对应的芯片种类,输入芯片信息,点击 Dock Chip 按钮。
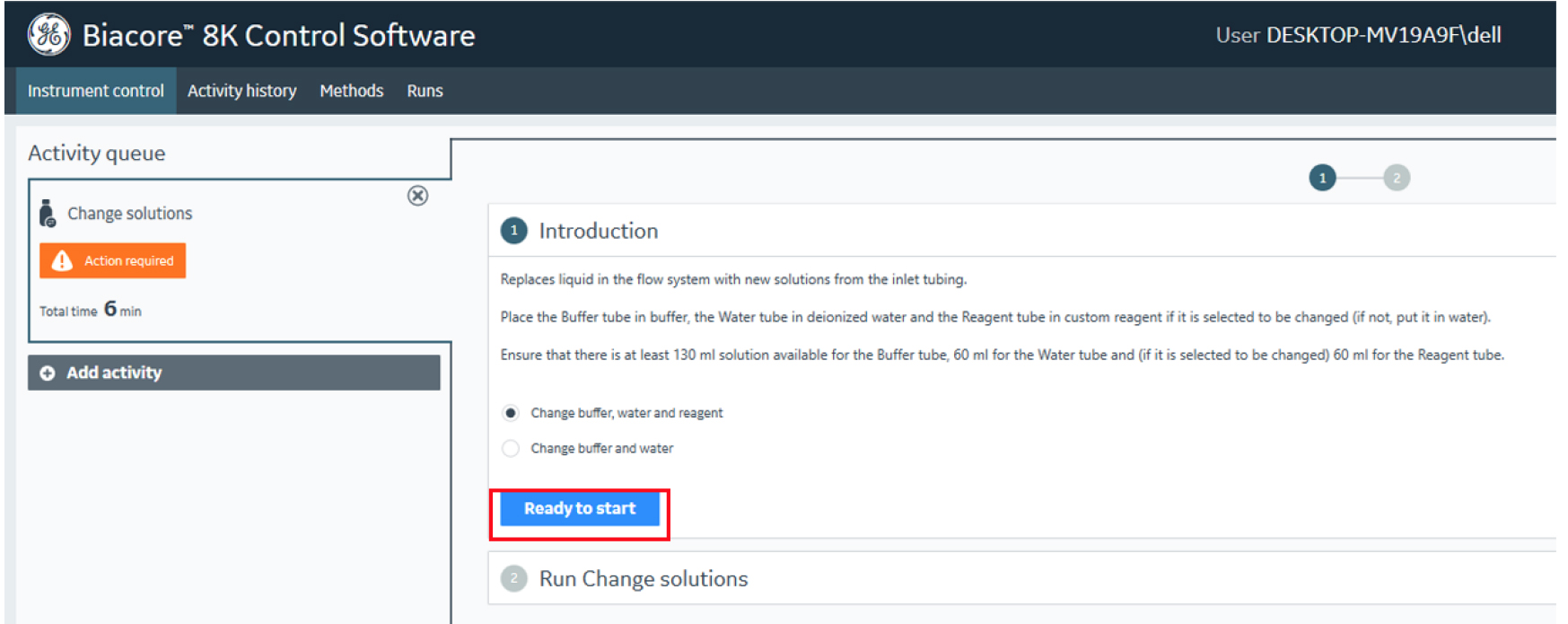
图3 点击“Ready to start”开始“Change solutions”
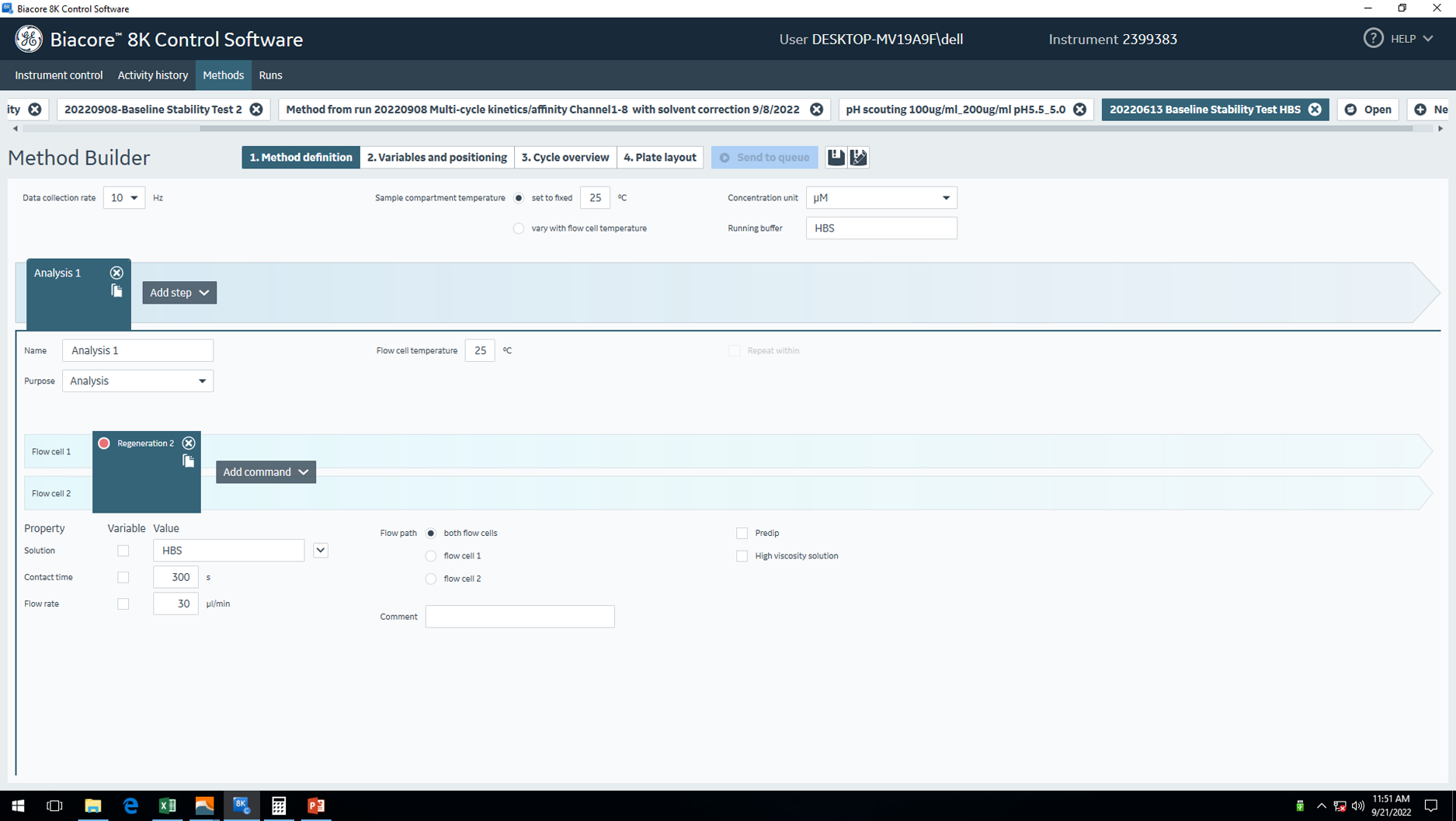
图4 Baseline Stabilization程序设置
二、配体偶联
- 配体偶联量的计算
本次实验中将HBO1-BRPF2复合蛋白作为配体固定在芯片上,其所需的偶联量按如下公式进行计算:
其中RL为对应Rmax所需的配体偶联量,MWligand为配体的相对分子质量,MWanalyte为分析物的相对分子质量,Sm为化学计量比(除已知外,一般默认为1:1,本实验为1:1),Rmax为配体与分析物结合的预估最大值。本次实验中,配体(Ligand)HBO1-BRPF2复合蛋白的分子量为38.3 kDa,不同酰基辅酶A为分析物(Analyte)其平均分子量约为800 Da,Rmax设为100 RU,化学计量比Sm为1。通过上面的公式计算配体偶联量RL值为 4787.5 RU。考虑到氨基偶联为随机偶联,这将导致部分固定的配体因空间位阻无法与分析物正常结合,而损失部分结合信号;另一方面,因为氨基偶联的效率不能达到100%,为了保证充分的结合信号,在实际偶联过程中,建议偶联量至少为 1.5倍的RL计算值,对于蛋白与小分子的亲和力测定,我们在实验过程中会偶联约2倍RL计算值的配体蛋白以充分体现小分子分析物的结合响应信号。 - 预富集实验(pH scouting)
因为本次实验所需的配体偶联量较高,而氨基偶联相对于其它偶联方法可以捕获较高的偶联量,所以本次实验中选择在CM5芯片上通过氨基偶联的方式来固定配体。在正式的氨基偶联实验前,需要通过预富集实验来摸索合适的pH缓冲液条件使配体蛋白带上正电荷,并富集在芯片表面,以此让配体蛋白能够在流动的环境中顺利发生氨基偶联反应。HBO1-BRPF2的等电点约为8.0,考虑到pH 4.0和pH 4.5的醋酸钠缓冲液对于该蛋白复合物而言条件较剧烈容易导致蛋白沉淀,所以本实验选择测试pH 5.0和pH 5.5两种醋酸钠缓冲条件。实验中,分别用pH 5.0和pH 5.5的醋酸钠缓冲液稀释配体蛋白至100 μg/mL,200 μg/mL两种浓度,上样至96孔板对应孔位。为了避免因移液器加样精准度不够导致取样针吸取空气产生异常的传感线,建议每孔所加体积比仪器程序设置的体积再多10 μL。程序设置以下四种富集条件(表1,图5):
表1. 预富集实验条件设置
| 醋酸钠缓冲液pH值 | 蛋白浓度(μg/mL) |
| 5.5 | 100 |
| 5.5 | 200 |
| 5.0 | 100 |
| 5.0 | 200 |
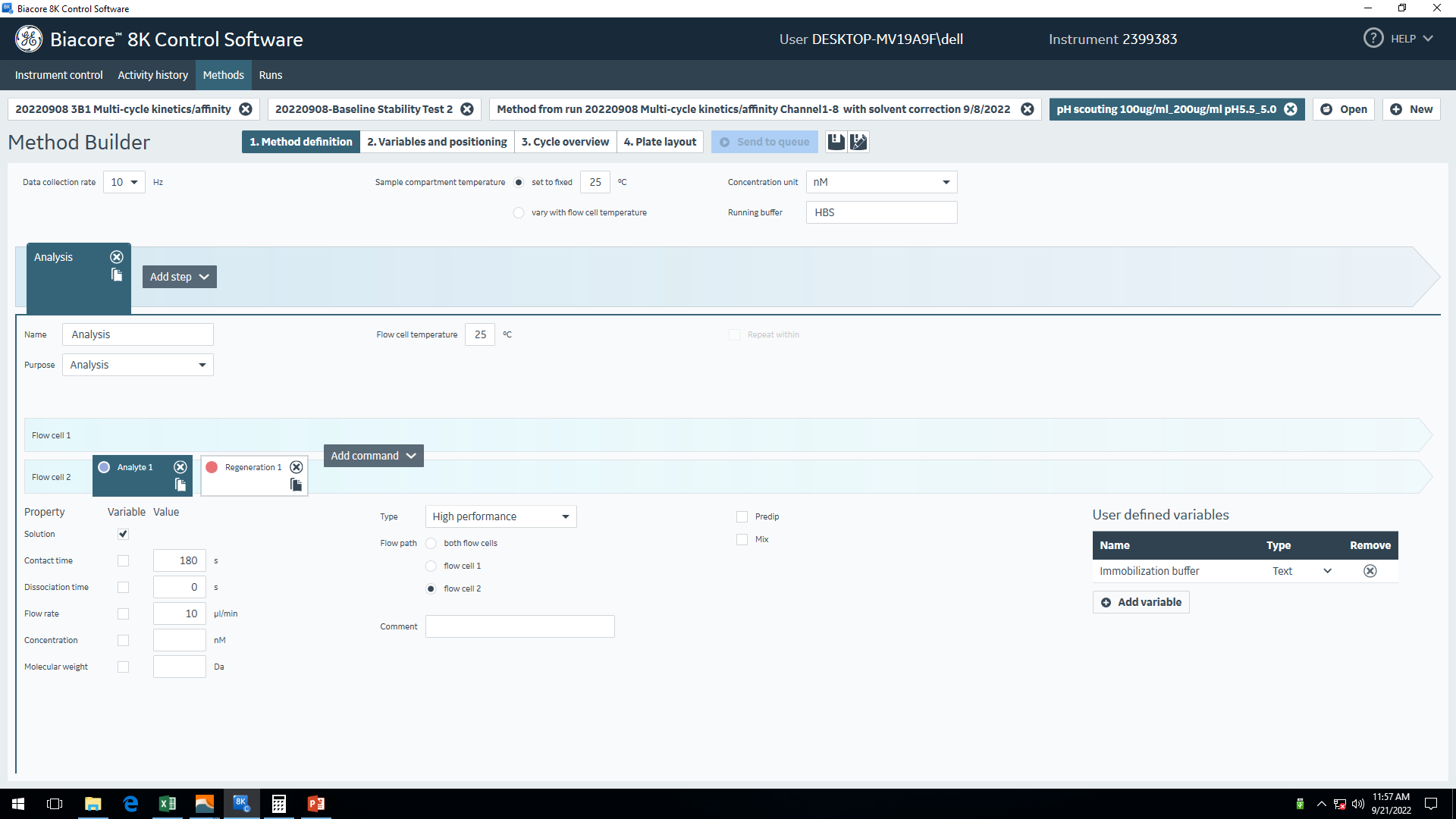
图5 pH scouting程序设置
预富集实验结束后,根据富集传感图(图6)结果,选择在蛋白质稳定的前提下最接近目标偶联量的富集条件。本次实验确定蛋白偶联的最适条件为200 μg/mL,pH 5.5,由于蛋白总量受限,蛋白浓度最终调整为150 μg/mL。
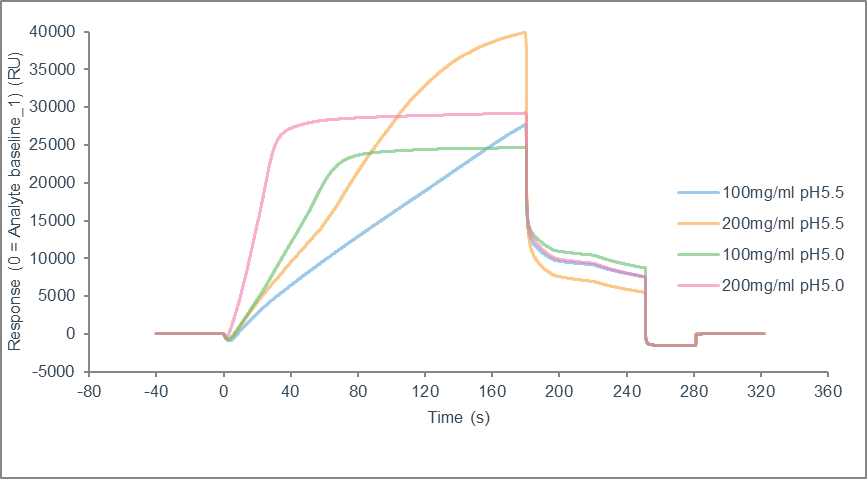
图6 pH scouting结果图
- 配体的氨基偶联
将HBO1-BRPF2复合蛋白用pH 5.5的醋酸钠缓冲液稀释至150 μg/mL,EDC与NHS以1:1的比例配制活化剂,整个制备过程需在冰上操作以充分保证活化剂的活性。乙醇胺为封闭剂。所有试剂每孔所加体积应比程序设置所需体积多10 μL,以防移液枪加样精准度不够导致进样针取样时因体积不够吸入空气。所有溶液都按“Positioning and plate layout”中的提示配制并加入96孔板后上机运行程序(图7)。活化剂与封闭剂的作用时长要相同,本次实验均设置为600 s。由于本次实验所需的配体偶联量较高,所以实验中设置配体偶联时长为900 s,流速为10 μL/min。偶联程序结束后,设置Baseline Stablization程序来去除未偶联以及偶联不牢固的配体蛋白。该程序运行需要至少6个以上循环,时长约1–2小时,以保证基线在300秒内下降的RU值小于10。
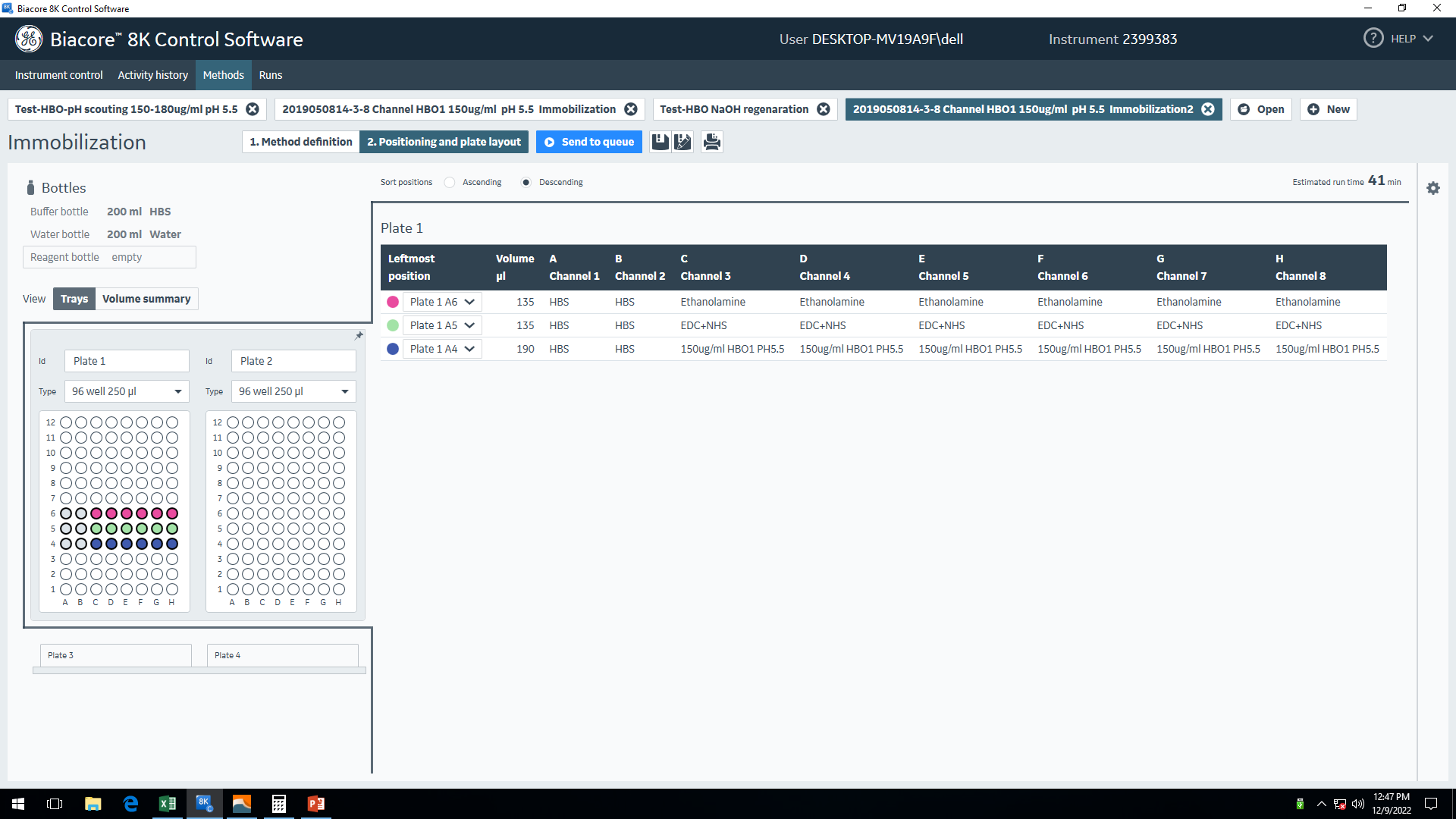
图7 配体偶联程序设置
三、分析物测试条件摸索在正式试验前,需要确定分析物的测试浓度范围。本实验测试了两个检测浓度,分别是1 μM和10 μM(图8)。
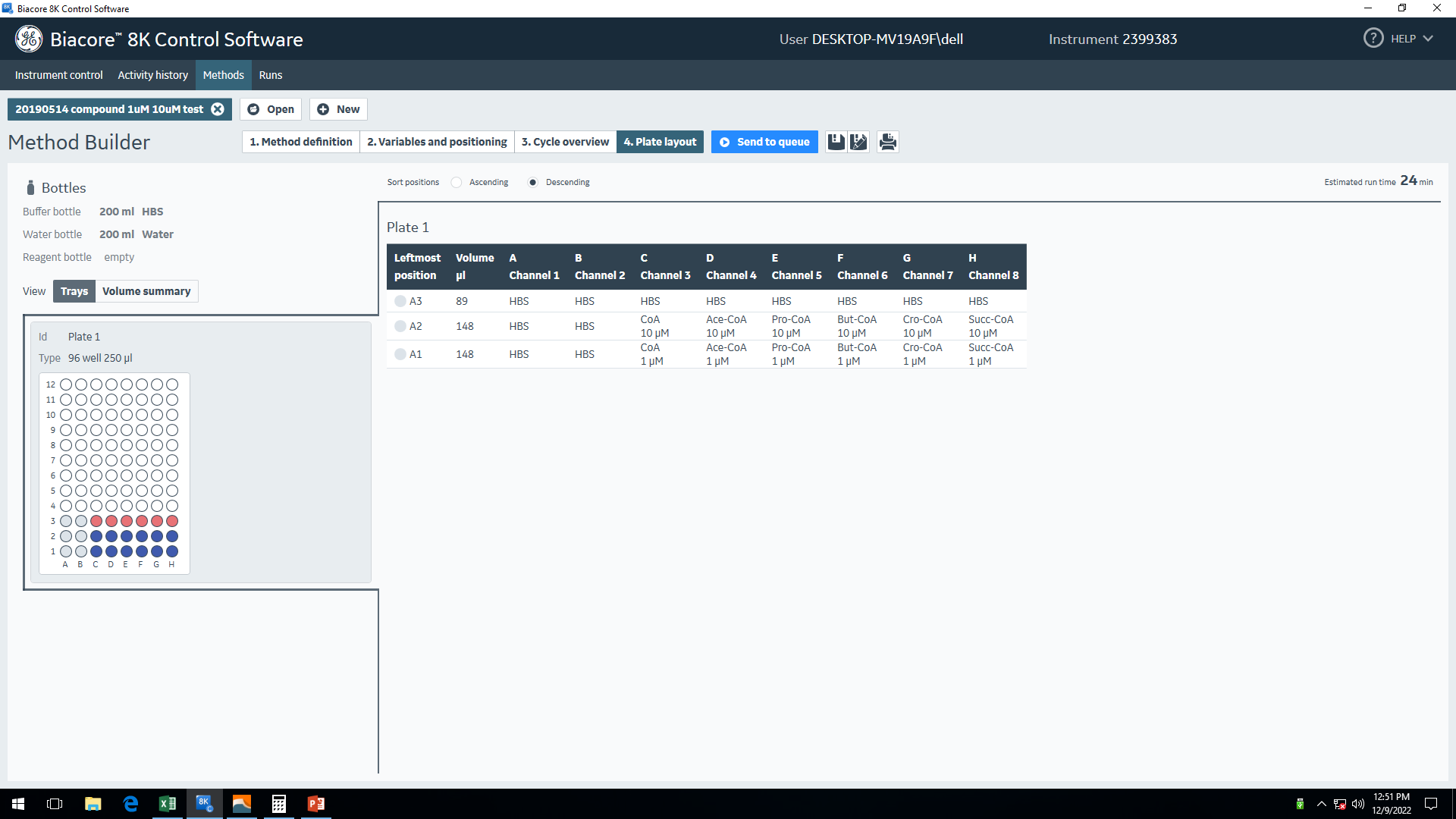 图8 分析物测试条件摸索程序设置
图8 分析物测试条件摸索程序设置结合测试结果最终将10 μM设定为多循环动力学检测方法中分析物最高浓度,后续浓度梯度以2倍梯度进行稀释,共10个浓度梯度,每种浓度均采取复孔的方式进行检测。
四、实验方法的建立以上预实验确定好了本实验所需的分析物测试条件(分析物以10 μM为最高浓度,往下2倍梯度稀释,10个浓度),即可开始正式实验。
计算小分子的浓度梯度。设置7个Start up(跑Buffer)和3个零浓度(溶液中分析物浓度为零)。从“Plate layout”中可以看到每个孔所需加入的液体种类和体积,还可以看到程序运行所需时间以及管路所需Running Buffer和水的总量(图9~11)。
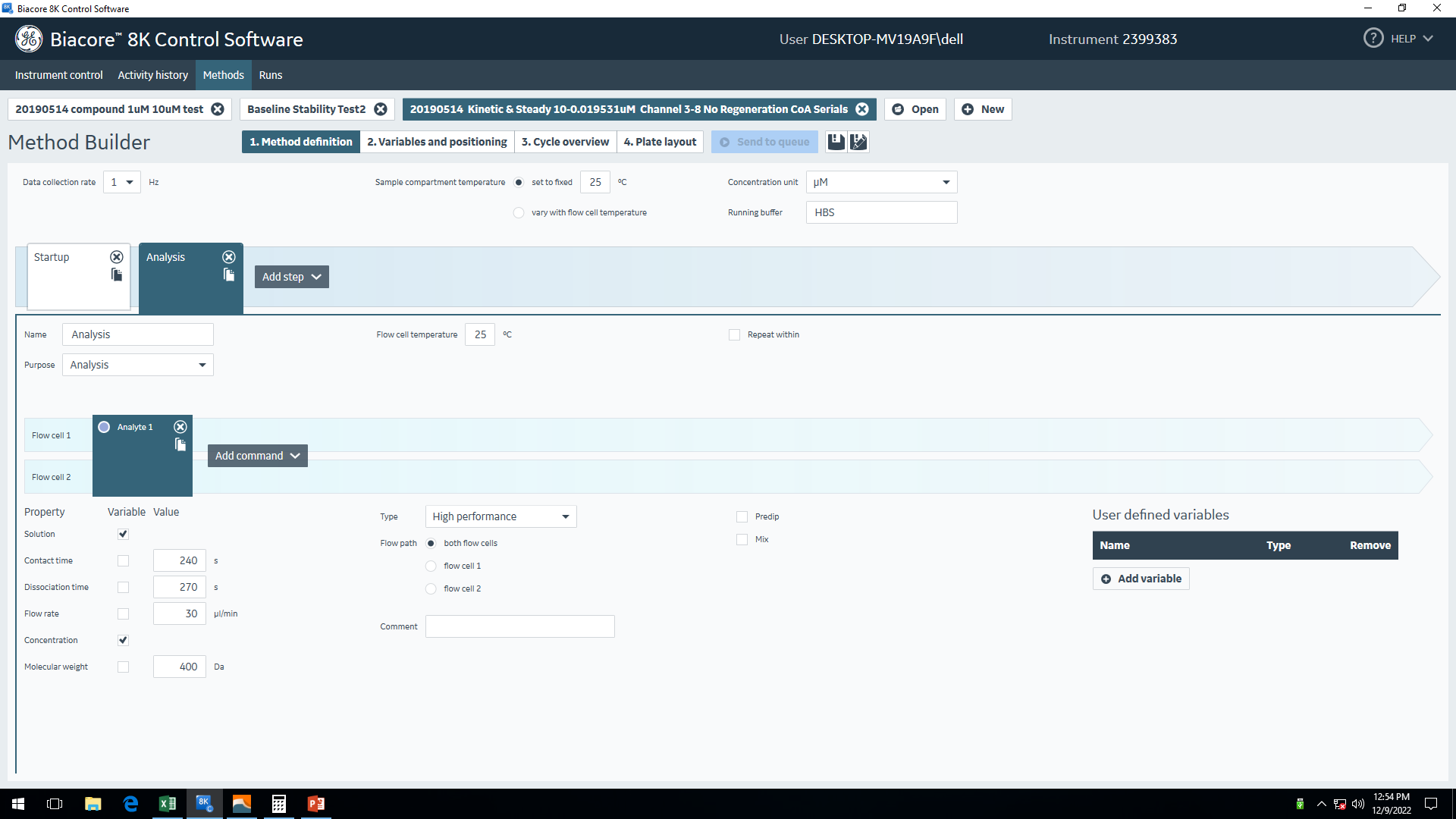 图9 正式实验程序设置——Method definition
图9 正式实验程序设置——Method definition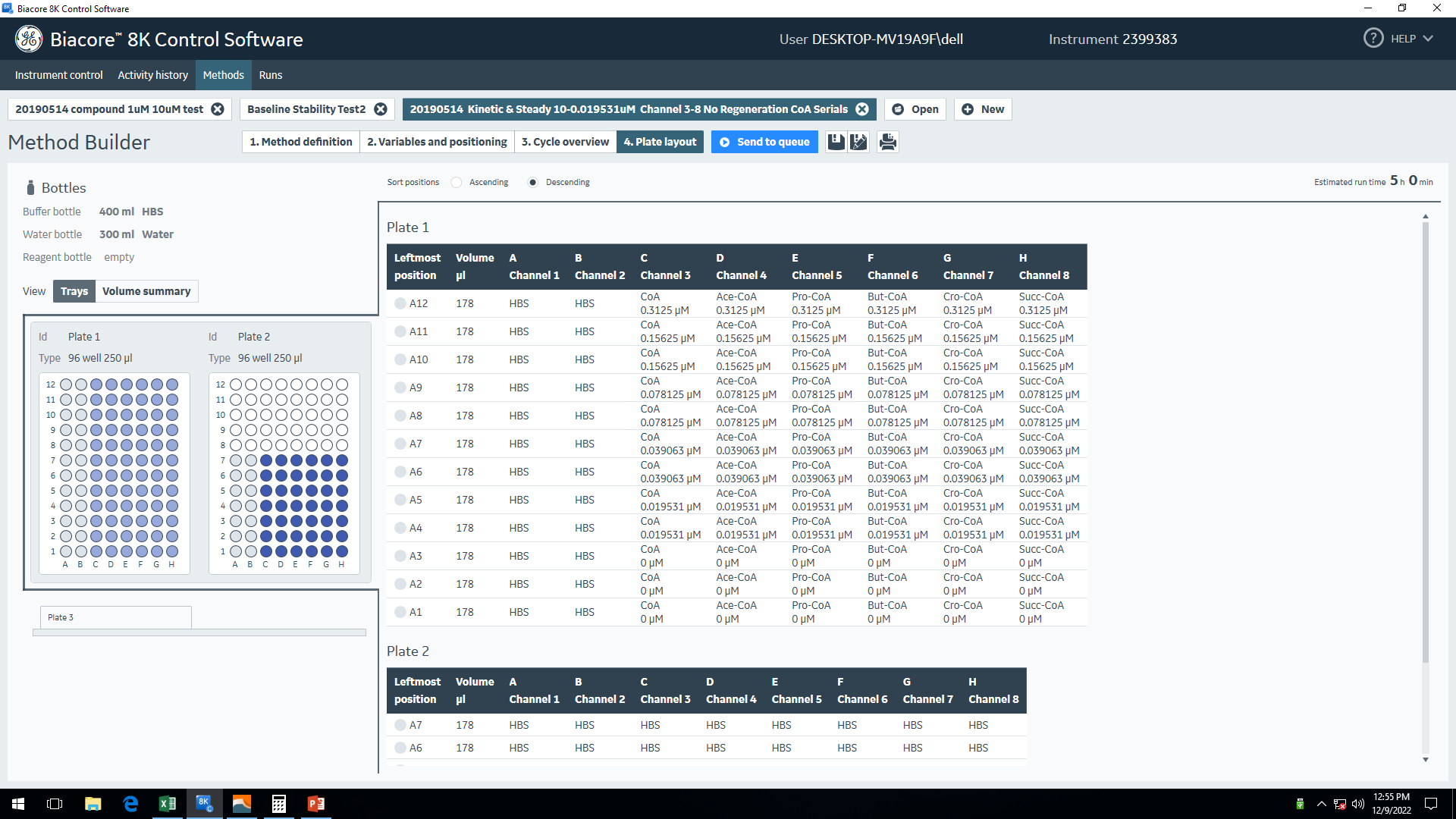 图10 正式实验程序设置——Variables and positioning
图10 正式实验程序设置——Variables and positioning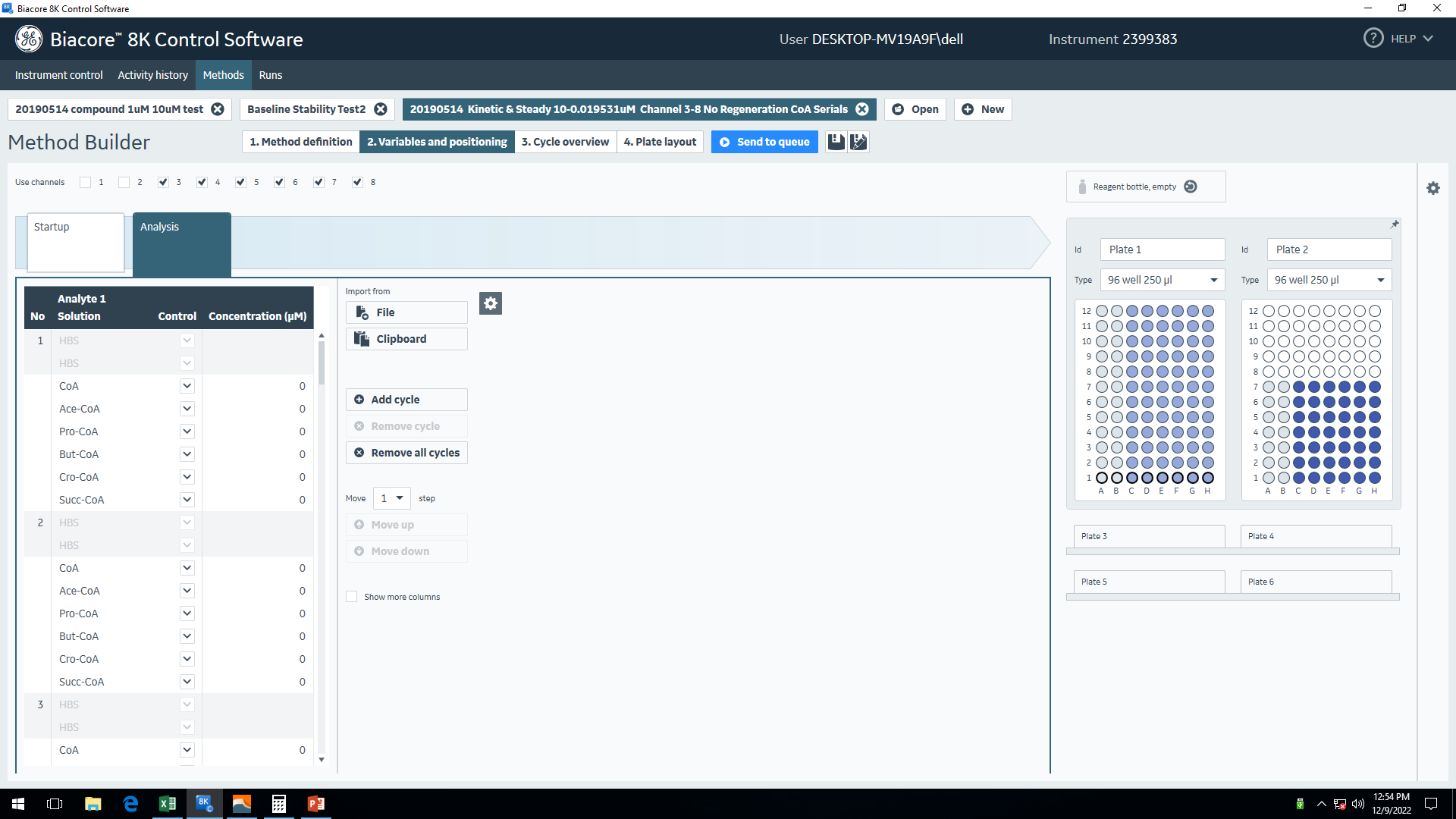 图11 正式实验——Plate layout
图11 正式实验——Plate layout五、样品制备以及上机检测
按照“Plate layout”表格中所显示的液体用量配制各溶液,每孔所加体积应多算10 μL左右,以防针头进样时吸空。本次实验中六种分析物均为水溶性小分子,按照分析物储液:水:10× HBS = 1:899:100将分析物1,000倍稀释到最高测试浓度10 μM,然后直接用Running Buffer将最高测试浓度的分析物进行两倍梯度稀释。
各溶液配制并充分混匀后参照表格中显示的排布加入96孔板中。检查瓶中Running Buffer和水的量是否够用,将制备好的96孔板封膜上机。注意检查96孔板A1角的放置位置和托盘在仪器中的放置方向。
六、数据分析与结果导出
实验结束后,直接从“Runs”中选择本实验结果,点击“Run Properties”,再点击“Open in evaluation software”在分析软件中打开结果,点击“Select evaluation method”中的“Multi-cycle kinetics-Evaluation method”,对实验结果进行质量判断与模型拟合。
下图为本实验的传感曲线图。从结果图可以看出两组曲线都是快上快下的模式,更接近稳态模型(图12)。
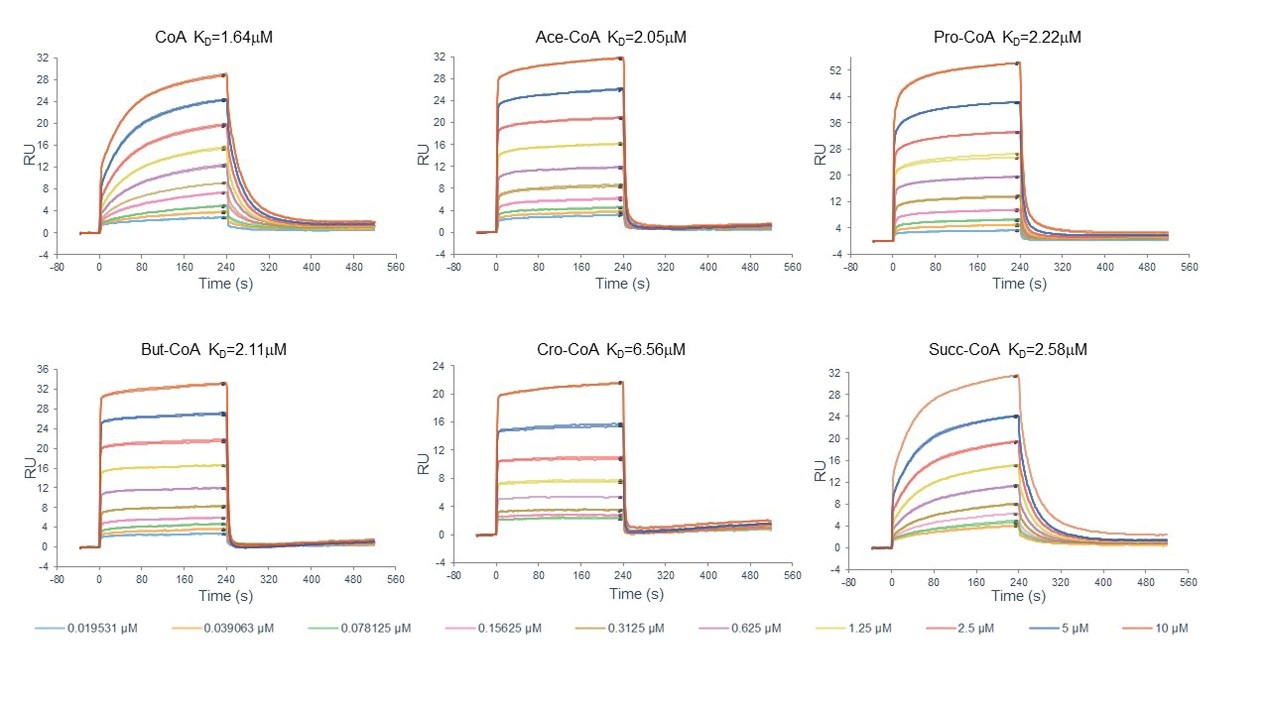
图12. HBO1–BRPF2与酰基辅酶A各变体的结合曲线。图中酰基辅酶A缩写分别为CoA:coenzyme A;Ace-CoA:acetyl-CoA;Pro-CoA:propionyl-CoA;But-CoA:butyryl-CoA;Cro-CoA:crotonyl-CoA;Succ-COA:succinyl-CoA。
六个通道的Baseline基线在循环递增过程中呈下降趋势,说明固定在芯片上配体蛋白有脱离芯片的可能。但相邻的两个cycle间的基线起始值变化非常微小,而且每个cycle内的基线保持平稳。(图13)。
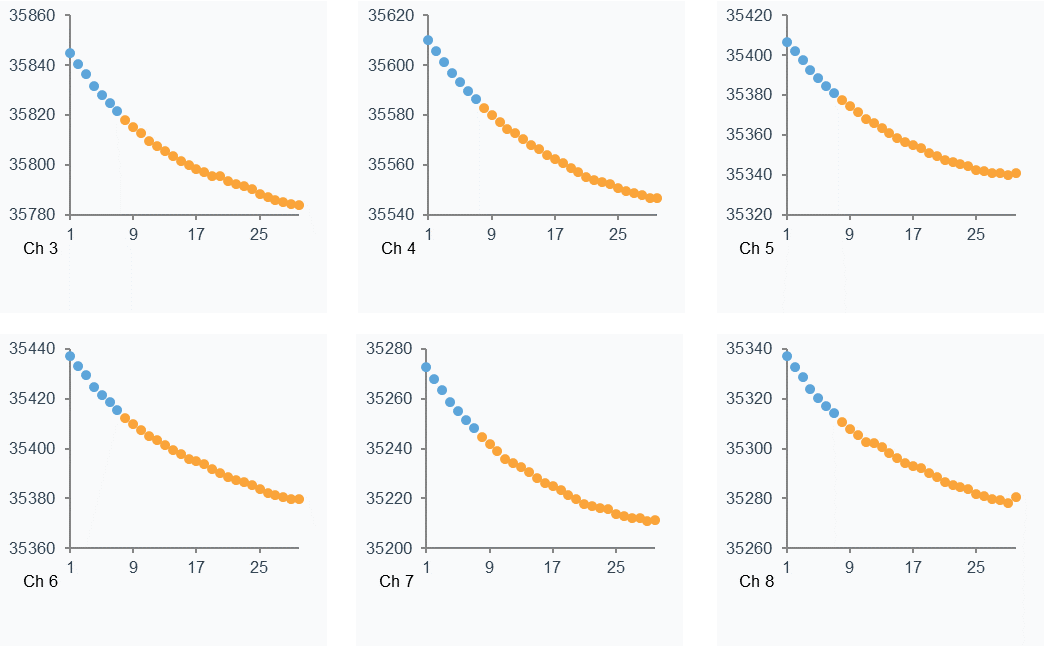
图13. Baseline(蓝色的点表示Start up部分,黄色的点表示Analysis部分)
Binding to reference结果图显示六个通道上每个循环的分析物与参比通道的结合响应值RU基本都在5以内,随着分析物浓度的增加,“Binding to reference”的值也逐渐增加(图14)。
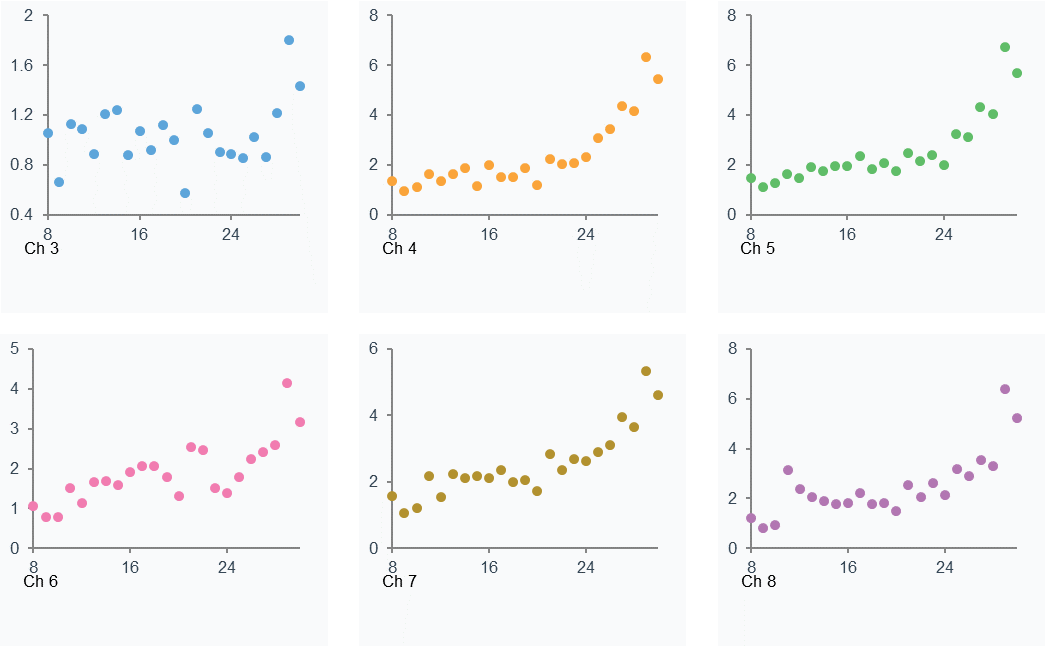
图14. Binding to reference
由于HBO1–BRPF2和CoA的结合曲线更倾向于稳态模型,本次实验数据分析采用稳态模型进行拟合。在实验中我们设计了重复实验即每个浓度做两复孔来确保拟合的KD值的可靠程度。稳态拟合的质量好坏除了仪器自带的质控标记以外,我们还需根据以下标准进行判断:① √(〖Chi〗^2 )<1/10 R_max,②蓝线单侧至少有两个浓度。六组数据的拟合结果都符合这两个标准(图15)。
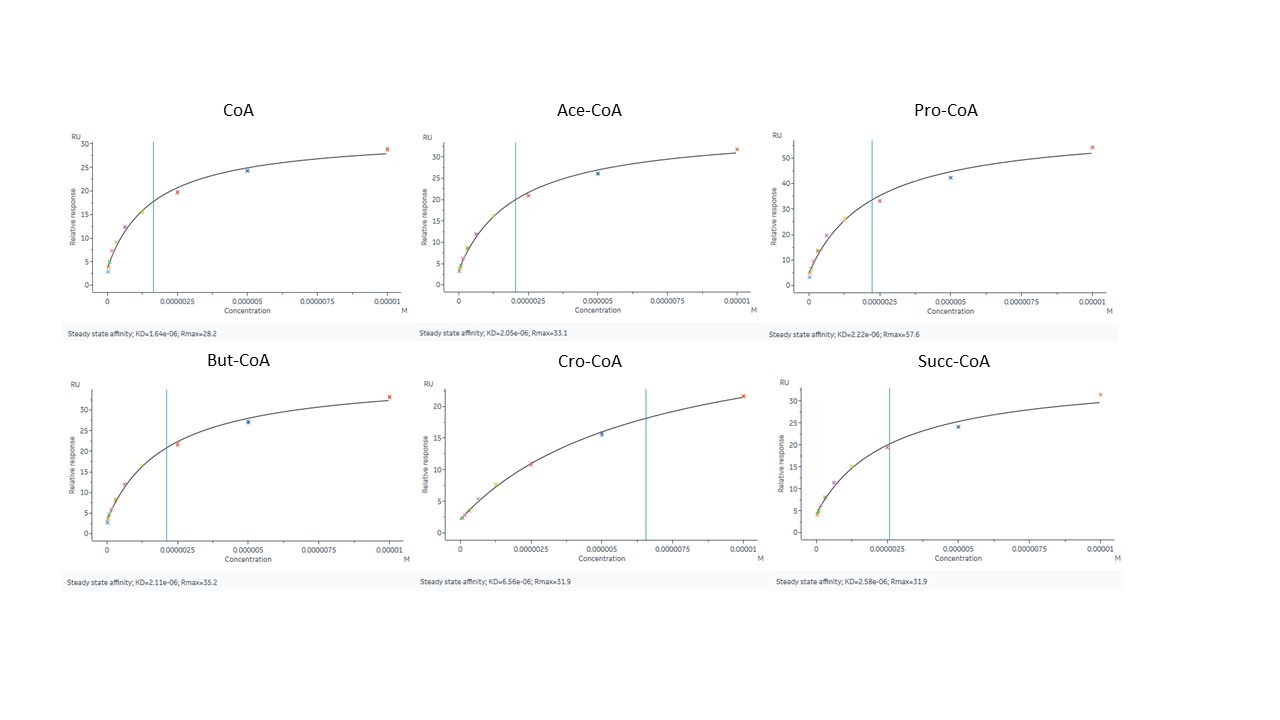
图15. 稳态模型拟合结果
结果导出:点击“Home”按钮,选择“Presentation”,将结果以Power Point文件形式导出,其中包含实验过程中的参数设置和结果图等信息。Power Point文件中每对互作的多浓度结合解离传感图可直接导出原始数据,并在Graphpad Prism软件中重新绘制高清传感图。
以上实验结果于2021年发表在Nucleic Acids Res国际期刊,题为:HBO1 is a versatile histone acyltransferase critical for promoter histone acylations。
实验注意要点
- Biacore 8K仪器要按时除盐除菌,至少每周换一次水,保证仪器管路的洁净与通畅。如果仪器下端滤阀处有明显漏液现象,提示仪器系统运行溶液中可能染菌或者有杂质导致滤膜堵塞渗漏,需重新更换经0.22 μm滤膜过滤的系统运行缓冲液,同时更换新的过滤器。实验中作者曾经历过系统运行缓冲液每次都是新鲜制备且经0.22 μm滤膜过滤之后才使用,但仍然发生了滤阀处漏液的现象。后经工作人员细致排查发现原因在于0.22 μm滤膜处于过期状态,本身就已经染菌了,但肉眼无法察觉,这样导致系统运行缓冲液其实在一段时间内都处于肉眼无法察觉的细菌污染状态,这些污染物累积在滤膜处,导致滤阀漏液。
- Biacore 8K仪器具有自动去除系统运行溶液中气泡的功能,所以SPR实验系统运行缓冲液Running Buffer可在0.22 μm滤膜过滤后即刻使用,无须超声除泡。但Biacore 8K仪器的进样针没有除泡功能,所以样品板内样品溶液须尽可能没有气泡存在,否则将产生异常的传感图。
- SPR实验中,仪器更换芯片后建议多执行几次Change Solutions的操作以充分保证仪器管路系统溶液环境与外置的Running Buffer环境一致,维持系统稳定性。在进行氨基偶联时,配体偶联量越多,偶联不充分,不稳定的现象也会越明显。所以偶联量大(>15,000 RU)的时候至少需要运行9个循环的基线稳定程序,以保证亲和力检测前基线足够平稳。
- 多数配体蛋白在25 °C室温条件下进行亲和力测定实验即可,因为在此条件下蛋白活性较高。但如果配体蛋白的热稳定性不好,则可以考虑将温度调至15 °C低温环境下进行实验。蛋白的热稳定性可以用蛋白质稳定性分子仪Prometheus NT.48进行检测。
- 预富集实验中用到的醋酸钠缓冲液共有4种pH,这4种pH可以在1个通道上分4个循环进行测试,也可以分别在4个通道上用一个循环完成。第二种方法节省时间,但会占用较多的通道,这些通道在下次使用前一定要充分冲洗干净。
- 预富集实验中蛋白浓度的选择:如果有其它的实验结果,则参考之前的实验;如果没有实验参考,且需要的偶联量较高的话,可以选择100 μg/ml蛋白浓度作为起始条件,以第一次预富集实验结果为参考,后续实验可以再根据实验结果改进。
- 在96孔板中准备蛋白偶联实验样品时,最好把活化剂、蛋白稀释液和封闭剂三行隔开,防止孔间细微液滴污染影响偶联效率。
- 在分析物测试条件摸索时,如果有其它实验(如ITC等)的实验结果,则可以作为参考,取10倍的KD值作为最高浓度;如果没有,则根据已有分析物的总量确定最高浓度(分析物最高浓度能达到多少就将最高浓度设为多少),不过同时要考虑系统以及配体所能承受最高DMSO浓度限制。
- 在分析物测试条件摸索时,建议设置1个零浓度和3个检测浓度,3个浓度即可拟合出一个可参考的KD值。再在初步拟合的KD值基础上可设定10倍KD值作为分析物最高浓度。
- 在进行蛋白与小分子化合物亲和力测定时,要根据配体的稳定性和分析物所处溶剂环境来确定Running Buffer。很多情况下,分析物是溶解在DMSO中的小分子化合物,那么需要将Running Buffer和所有浓度的小分子化合物统一成一致的DMSO含量。
- Running Buffer的选择对实验的成功十分重要。当预实验的结果不理想时,如非特异性结合比较多,则可以考虑改进Running Buffer,如增加盐浓度或者添加P20等表面活性剂,或者更换其它类型的缓冲溶液,以降低配体与分析物的非特异性结合。
- 如果分析物解离速度很慢,则需要进行再生,本实验中采用2 M MgCl2作为再生试剂。
- 使用动力学模型进行拟合时可以对Rmax、tc和RI值进行适当调整。
- 结果导出我们常用Excel格式或PPT格式,PPT格式中包含了所有曲线的所有时间点的数据,可以根据这些原始数据用GraphPad等软件作图获取高清曲线。
致谢
“HBO1 is a versatile histone acyltransferase critical for promoter histone acylations”该课题得到了中国科学技术部[2017YFA0504201 to J.W.]、国家自然科学基金会[31961133009 to J.W., 31800622 to J.D., 31801060 to W.W.]、上海市科学技术委员会[20JC1411500 to J.W.]、中国科学院[战略重点研究计划XDB37030305 to J.D.]的资助。文中SPR实验在中国科学院分子细胞科学卓越创新中心化学生物学技术平台完成,感谢化学平台老师们的指导。
参考文献
- Xiao, Y., Li, W., Yang, H., Pan, L., Zhang, L., Lu, L., Chen, J., Wei, W., Ye, J., Li, J., et al. (2021). HBO1 is a versatile histone acyltransferase critical for promoter histone acylations. Nucleic Acids Res. 49(14): 8037–8059. https://doi.org/10.1093/nar/gkab607
Please login or register for free to view full text
View full text
Download PDF
Q&A
Copyright: © 2025 The Authors; exclusive licensee Bio-protocol LLC.
引用格式:王烁英, 叶洁, 吴萌, 杨卓, 兰姝珏, 李文婧. (2025). 利用SPR技术检测HBO1-BRPF2与不同酰基辅酶A分子间相互作用亲和力. // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011023. DOI:
10.21769/BioProtoc.1011023.
 How to cite:
How to cite: Wang, S. Y., Ye, J., Wu, M., Yang, Z., Lan, S. J. and Li, W. J. (2025). Detecting the Binding Affinities Between HBO1-BRPF2 and Different acyl-CoAs by SPR Technology. // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011023. DOI:
10.21769/BioProtoc.1011023.
