摘要: 目的:通过表面等离子共振技术(SPR)的Dual进样模式表征中药来源活性小分子与靶标的异位协同作用。方法:将靶标蛋白以氨基偶联的方式固定在CM5芯片上,再利用Dual进样模式将分析物A、分析物B和AB混合物以不同的进样顺序流过CM5芯片表面,记录响应值的变化。结果:AB混合物的相对响应值大于单独进样分析物A和分析物B的相对响应值以及两者之和;进样分析物A或分析物B与靶标蛋白预结合,可对分析物A与分析物B的协同作用产生影响。结论:本文使用Dual进样模式以及两种活性分子的不同进样顺序与方式,通过比较相对响应值并计算协同系数,发现分析物A与分析物B之间存在协同互作。本实验方法可应用于判断活性小分子之间的协同互作关系,与其他分子互作技术相比,本文的实验方案具有实时、非标记、快速及互作信息更全面等多个优势。
关键词: SPR, 异位, 协同互作, Dual进样模式
材料与试剂
- PBS(10×)溶液(Cytiva,产品目录号:BR100672)
- Tween-20溶液(泰坦生物,产品目录号:G89190B)
- DMSO(泰坦生物,产品目录号:79527O)
- pH 5.5醋酸钠缓冲液(Cytiva,产品目录号:BR100352)
- 氨基偶联试剂盒(Cytiva,产品目录号:BR100050)
- Series S CM5芯片(Cytiva,产品目录号:29149603)
- 1.5 mL EP管(爱思进,产品目录号:MCT-150-C)
- 4 mL玻璃管(Thermo,产品目录号:4-SV)
- 橡胶帽(Cytiva,产品目录号:BR100411)
- 0.22 μm孔径滤膜(泰坦生物,产品目录号:FPE204030)
- 靶标蛋白偶联阶段选用的缓冲液为PBST(见溶液配方)
- 测试分析物阶段选用的缓冲液为300 mL含1.4% DMSO的PBST(见溶液配方)
- 溶剂校正溶液(见溶液配方)
仪器设备
- 分子互作分析仪(Cytiva,产品型号:Biacore T200)
- 实验室水纯化系统(Millipore,产品型号:Direct-8)
- 制冰机(Panasonic,产品型号:SIM-F149AY65-PC)
- 过滤装置(Thermo,产品型号:Ds0320-5033)
实验步骤
一、实验准备
- 仪器维护
- 将仪器内芯片更换为维护芯片。
- 将缓冲液更换为Milli-Q H2O(MQ H2O)。
- 在操作界面选择Tools,再选择Prime。
- 待Prime结束后,选择Tools,点击More Tools,选择Desorb,按照程序设定准备需要的试剂,运行Desorb程序。
视频1 芯片更换
- 仪器准备
将缓冲液更换为含0.05% Tween-20的1× PBS(PBST),在操作界面选择Change chip,将维护芯片更换为新的CM5实验芯片,填写芯片相关信息,点击Dock chip,在操作界面选择Tools,再选择Prime。
二、配体的偶联本实验采用CM5芯片,将偶联试剂盒中N-羟基琥珀酰亚胺(NHS)和1-乙基-3-(3-二甲氨基丙基)碳二亚胺(EDC)混合为终浓度为50 mM NHS与200 mM EDC的活化试剂,将活化试剂注射7 min活化芯片表面的羧基。将靶标蛋白用pH 5.5的10 mM 醋酸钠缓冲液,稀释至30 μg/mL,30 μL/min流速,持续时间为700 s,固定在CM5芯片表面[1]。最后用1 M乙醇胺(pH 8.5)封闭表面。最终偶联量为:15961.7 RU(图1)。
注:可以通过Biacore T200 Control Software打开偶联结果(.blr为后缀的文件),选择偶联的Cycle,右键选择Copy Graph导出偶联结果图(如图1)。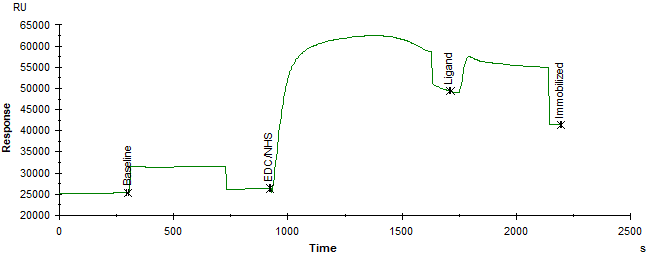 图 1 靶标蛋白偶联结果
图 1 靶标蛋白偶联结果三、实验方法的建立:协同互作测定的具体实验方法
- 方法设置
- 软件控制界面选择New Methods,在方法编辑界面设置General Settings(图2),填写缓冲液(1.4% DMSO PBST)信息,本实验只在一个通道上偶联靶标蛋白,因此检测通道选择Dual。
注:选择分析物浓度单位为nM,系统容易错误识别浓度单位μM,需要特别注意。DMSO浓度可以根据不同实验调整。数据采样频率保持10 Hz不变,样品舱温度根据样品实际情况确定,一般保持在25℃,对于温度敏感的样品,可降低温度至10 ℃。
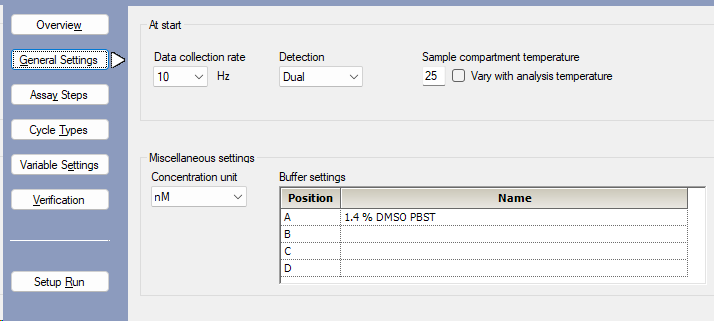
图2 General Settings的设置界面
- 选择Assay Steps点击New添加分析步骤(图3),添加Start up步骤、Sample步骤和Solvent Correction步骤,将Solvent Correction步骤与Sample步骤进行关联。
注:溶剂校正溶液配方见表4.
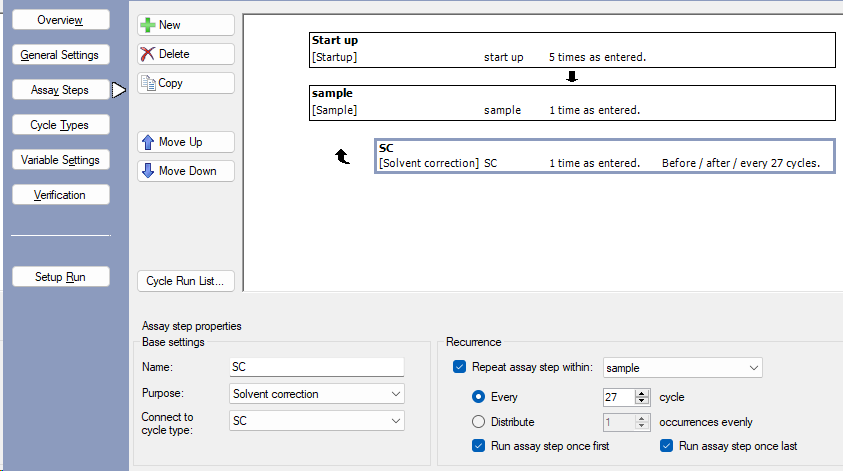
图3 Assay Steps的设置界面
- 在Cycle Types中点击New添加Start up循环、Sample循环和Solvent Correction循环(图4),在每个循环下点击Insert添加具体分析方法。
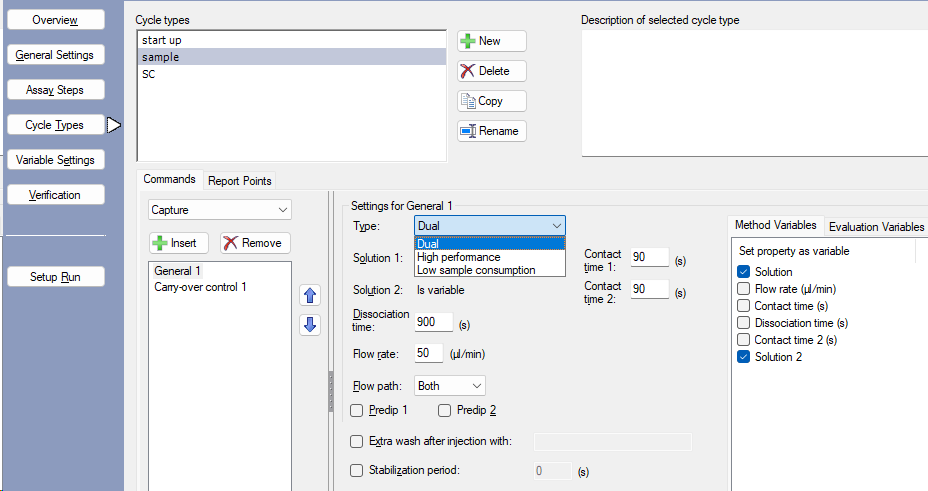
图4 Cycle Types与Dual进样模式的设置界面
- 在Cycle Types中将Sample循环的进样方式设定为Dual(图4),分别将Solution的结合时间设置为90 s,Solution 2的结合时间设置为90 s,解离时间设置为900 s,流速50 μL/min,流经通道选为Both。
- 在Variable Settings中设置分析物的进样顺序(图5),Solution为先进样的分析物,Solution 2为后进样的分析物。
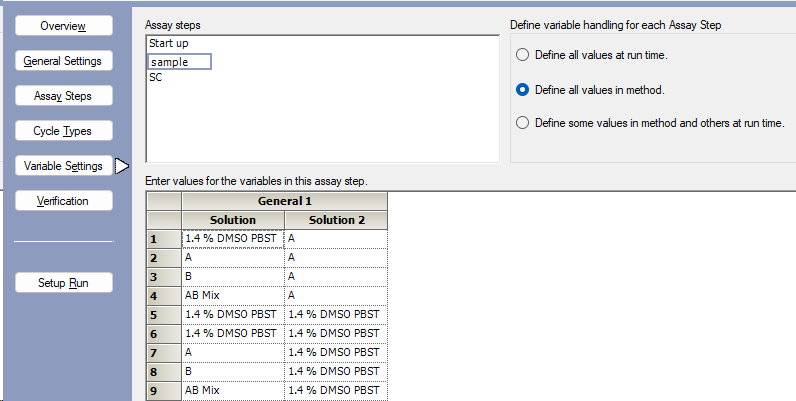
图5 设置分析物的进样顺序
- 点击Verification,验证以上设置是否符合软件自检逻辑,确定所有必要信息均已正确填写。
- 点击Setup Run,选择参比通道扣减活性通道,点击Next,检查整个分析流程所需的全部分析物,也可以点击Overview检查整个实验流程设置,若需修改可以随时退回调整设置。
- 点击Next,选择Prime before run。
- 加样
- 按照Rack Positions所示(图6)准备样品。
注:为防止实验过程中样品中溶剂挥发影响DMSO浓度的一致性,需要对所有的EP管以及玻璃管加盖橡胶帽。
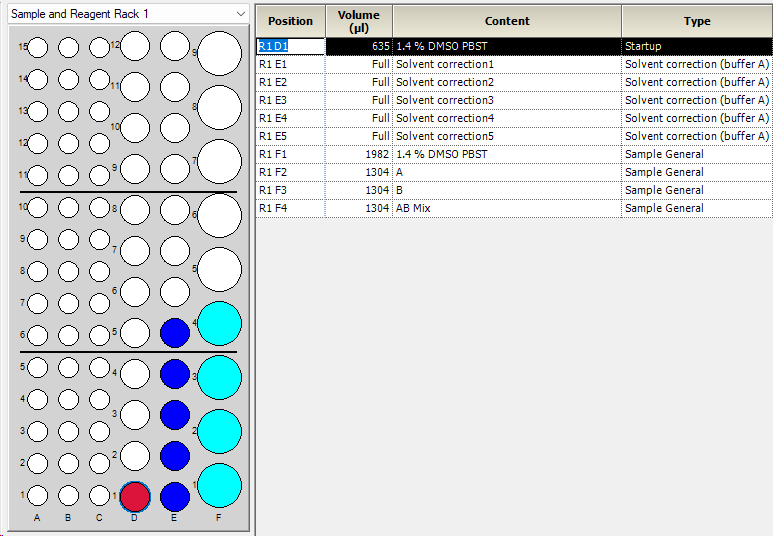
图 6 Rack Positions的设置界面
- 确认所需1.4% DMSO PBST的体积,确认所有分析物以及溶剂校正液都位于选定位置,确认分析流程的时间。
- 开始分析
再次确认各项无误后,点击Start,保存分析文件,开始进行分析流程。
实验注意要点
- 为了让整个仪器的流路控制进入稳定状态,应在正式实验开始前执行Prime与Start up程序。
- 在缓冲液含有DMSO等会对信号产生较大影响的有机溶剂时,为了避免DMSO浓度差异影响响应值进而带来误差,因此需要加入溶剂校正流程以扣除缓冲液中DMSO浓度差异带来的影响。
- 所有溶液和样品都需要经过0.22 μm孔径的水系或有机系滤膜过滤。
- 靶标蛋白应在冰上保存避免活性损失。
结果与数据分析
表面等离子共振技术(SPR)的原理基于表面等离子波的激发与折射率变化。当光束通过透明介质照射到金属薄膜表面时,特定角度的光会激发金属表面的电子,形成表面等离子波。当分析物与金属表面上固定的配体分子结合时,局部折射率发生变化,导致等离子共振角度发生偏移。这一变化可以通过反射光强度或共振角的变化来实时监测,从而反映分子相互作用的动力学信息,如结合速率、解离速率和亲和力等。
本实验采用Biacore T200的Dual进样模式(图7),即在一个循环两次进样的方式,对两种活性分子与靶标不同表位同时相互作用的协同效应进行分析[2,3]。根据不同样品以及不同进样顺序所得到的相对响应值进行定性分析并计算其协同系数,考察进样顺序等对协同作用的影响[4–6]。
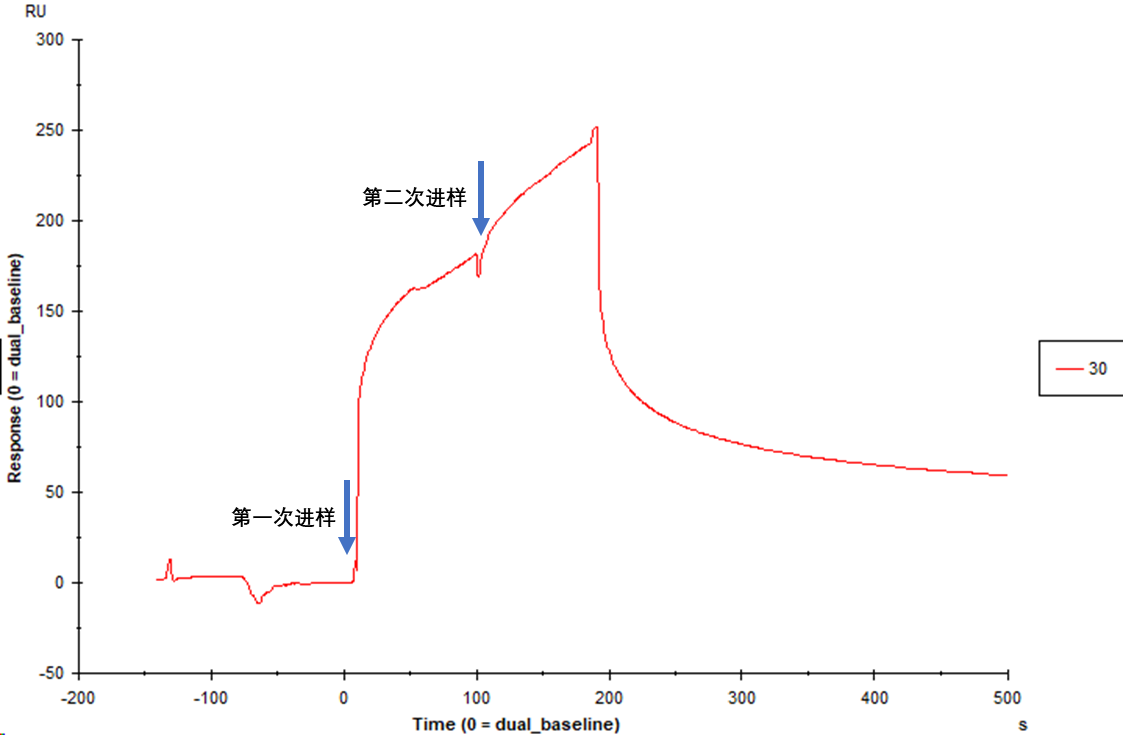
图 7 通过Dual进样模式表征协同作用结果示意图
通过协同系数评价协同作用,协同系数的计算公式为:
协同系数(%)=(RelRespAB - RelRespA - RelRespB)/(RelRespA + RelRespB)×100
以上RelResp均采用Solution 2进样分析物时的响应值扣减进样1.4 % DMSO PBST时的响应值差值纳入计算,其中RelRespAB为AB混合物的相对响应值;RelRespA为分析物A的相对响应值;RelRespB为分析物B的相对响应值。
- 测试无预结合条件下分析物A、分析物B与靶标的协同作用
本次分析先进样1.4% DMSO PBST再进样三组分析物:分析物A、分析物B、AB混合物,分别考察三组分析物各自的相对响应值(图8)。
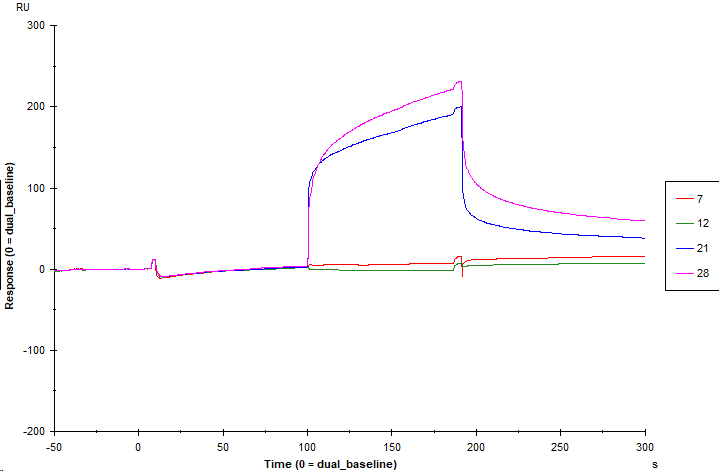
图 8 无预结合条件下各分析物的结合解离曲线图
结果测得分析物A的相对响应值为6.5 RU,分析物B的相对响应值为163.6 RU,AB混合物的相对响应值为219.7 RU(表1),AB混合物的响应值大于分析物A与分析物B响应值之和,所得结果提示分析物A与分析物B之间存在协同作用。根据协同系数的计算公式得到无预结合条件下分析物A、分析物B与靶标蛋白互作的协同系数为29.2%。
表1 无预结合条件下各分析物的响应值
| Cycle | Solution | Solution 2 | Resp(RU) | RelResp(RU) |
| 12 | 1.4 % DMSO PBST | 1.4 % DMSO PBST | 1.3 | 0 |
| 7 | 1.4 % DMSO PBST | 10 μM A | 7.8 | 6.5 |
| 21 | 1.4 % DMSO PBST | 10 μM B | 164.9 | 163.6 |
| 28 | 1.4 % DMSO PBST | 10 μM AB Mix | 221.0 | 219.7 |
- 测试分析物A预结合对分析物A、分析物B与靶标协同作用的影响
为了探究分析物A与分析物B之间的协同作用是否受到分析物A预先结合靶标蛋白的影响,本次分析先进样分析物A与靶标蛋白预结合,通过Dual进样模式再进样三组分析物:分析物A、分析物B、AB混合物,分别考察三组分析物各自的相对响应值(图9)。
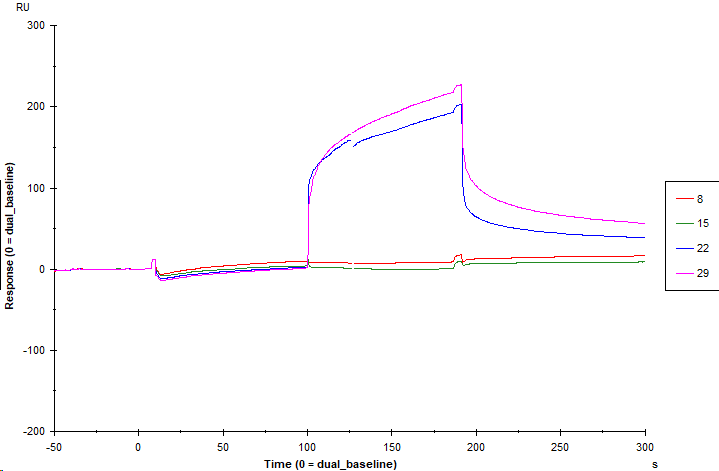
图9 分析物A预结合后各分析物的结合解离曲线图
结果测得分析物A的相对响应值为5.7 RU,分析物B的相对响应值为189.0 RU,AB混合物的响应值为213.7 RU(表2),AB混合物的响应值大于分析物A与分析物B响应值之和,所得结果进一步证明分析物A与分析物B之间存在协同作用。根据协同系数的计算公式得到分析物A预结合条件下分析物A、分析物B与靶标蛋白互作的协同系数为9.8%,表明分析物A预先结合靶标蛋白使得分析物A与分析物B之间的协同作用下降。
表2 分析物A预结合后各分析物的响应值
| Cycle | Solution | Solution 2 | Resp(RU) | RelResp(RU) |
| 15 | 10 μM A | 1.4 % DMSO PBST | 3.6 | 0 |
| 8 | 10 μM A | 10 μM A | 9.3 | 5.7 |
| 22 | 10 μM A | 10 μM B | 192.6 | 189.0 |
| 29 | 10 μM A | 10 μM AB Mix | 217.3 | 213.7 |
- 测试分析物B预结合对分析物A、分析物B与靶标协同作用的影响
为了探究分析物A与分析物B之间的协同作用是否受到分析物B与靶标蛋白预结合的影响,本次分析先进样分析物B与靶标蛋白预结合,通过Dual进样模式再进样三组分析物:分析物A、分析物B、AB混合物,分别考察三组分析物各自的相对响应值(图10)。
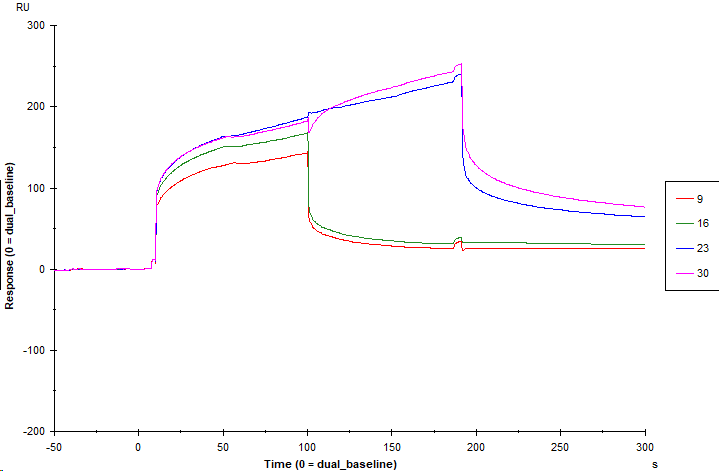
图10 分析物B预结合后各分析物的结合解离曲线图
结果测得分析物A的相对响应值为-5.6 RU,分析物B的相对响应值为198.7 RU,AB混合物的相对响应值为211.5 RU(表3),AB混合物的响应值大于分析物A与分析物B响应值之和,也提示分析物A与分析物B之间存在协同作用。但扣减缓冲液响应值后,分析物A的相对响应值为负值,推测分析物A可能可以加快分析物B的解离速率。进一步计算得到分析物B预结合条件下分析物A、分析物B与靶标蛋白互作的协同系数为9.5%,表明分析物B预先结合靶标蛋白也使得分析物A与分析物B之间的协同作用下降。
表3 分析物B预结合后各分析物的响应值
| Cycle | Solution | Solution 2 | Resp(RU) | RelResp(RU) |
| 16 | 10 μM B | 1.4 % DMSO PBST | 31.6 | 0 |
| 9 | 10 μM B | 10 μM A | 26.0 | -5.6 |
| 23 | 10 μM B | 10 μM B | 230.3 | 198.7 |
| 30 | 10 μM B | 10 μM AB Mix | 243.1 | 211.5 |
- 结论
通过对分析物A、分析物B和AB混合物的相对响应值进行分析,AB混合物与靶标蛋白的相对响应值大于单独的分析物A与分析物B两者相对响应值之和,表明分析物A与分析物B二者混合后与靶标蛋白的结合更强,提示两者在存在协同作用。二者的协同作用受到分析物本身与靶标蛋白预结合的影响,通过协同系数对协同作用的评价,在分析物A或分析物B与靶标蛋白预结合条件下所得到的协同系数比无预结合条件下所得到的协同系数低,提示预结合不利于分析物A、分析物B与靶标的协同作用。我们推测分析物A或分析物B与靶标预结合后,可能诱导靶标蛋白构象发生相反方向的改变,不利于另一分析物的结合,但分析物A、分析物B同时结合时可以诱导靶标蛋白产生不同于上述两种构象的新的优势构象,进而发挥协同作用。实验结果表明通过Dual进样模式可以表征两种活性分子与靶标之间的协同作用,同时明确预结合对于协同作用的影响。本实验方法可应用于判断活性分子之间的协同互作关系,并做定量分析。
溶液配方
- 本实验在靶标蛋白偶联阶段选用的缓冲液为PBST,其配制方法为取容量为1 L的洁净玻璃瓶,加入100 mL PBS(10×),5 mL 10% Tween-20,加MQ H2O补充至1L,充分混匀后,将PBST通过0.22 μm孔径的水系滤膜过滤。
- 本实验在测试分析物阶段选用的缓冲液为300 mL含1.4% DMSO的PBST,其配制方法为取容量为500 mL的洁净玻璃瓶,加入295.6 mL PBST,加入4.2 mL 纯DMSO,充分混匀后,将1.4% DMSO PBST通过0.22 μm孔径的有机系滤膜过滤。
- 按照表4配制溶剂校正溶液
表4 溶剂校正溶液配方
| 1 | 2 | 3 | 4 | 5 |
| DMSO浓度 | 1.2% | 1.3% | 1.4% | 1.5% | 1.6% |
| 纯DMSO体积(μL) | 0 | 0 | 0 | 1 | 2 |
| 1.4% DMSO PBST体积(μL) | 860 | 930 | 1000 | 999 | 998 |
| PBST 体积(μL) | 140 | 70 | 0 | 0 | 0 |
致谢
感谢国家自然科学基金(82173798)提供的经费支持。感谢上海中医药大学交叉科学研究院葛广波、朱广灏提供的两种中药来源的活性分子及靶标蛋白。
参考文献
- Florinskaya, A., Ershov, P., Mezentsev, Y., Kaluzhskiy, L., Yablokov, E., Medvedev, A. and Ivanov, A. (2018). SPR Biosensors in Direct Molecular Fishing: Implications for Protein Interactomics. Sensors. 18(5): 1616. https://doi.org/10.3390/s18051616
- Patching, S. G. (2014). Surface plasmon resonance spectroscopy for characterisation of membrane protein–ligand interactions and its potential for drug discovery. Bba-biomembranes. 1838(1): 43–55. https://doi.org/10.1016/j.bbamem.2013.04.028
- Xing, J., Tan, R., Huang, F. and Tian, N. (2024). Integrated analyses for identification of a three‐gene signature associated with Chaihu Shugan San formula for hepatocellular carcinoma treatment. J Cell Mol Med. 28(8): e18211. https://doi.org/10.1111/jcmm.18211
- Lee, J. J., Kong, M., Ayers, G. D. and Lotan, R. (2007). Interaction Index and Different Methods for Determining Drug Interaction in Combination Therapy. J Biopharm Stat. 17(3): 461–480. https://doi.org/10.1080/10543400701199593
- Senapati, S., Biswas, S., Manna, S., Ros, R., Lindsay, S. and Zhang, P. (2018). A Y-Shaped Three-Arm Structure for Probing Bivalent Interactions between Protein Receptor–Ligand Using AFM and SPR. Langmuir 34(23): 6930–6940. https://doi.org/10.1021/acs.langmuir.8b00735
- 陈凯歌, 何诣函, 杨美若, 王明花 (2023). 表面等离子体共振技术在癌症标志物检测中的应用进展. 化工新型材料 51(S2): 135-140+149.
Please login or register for free to view full text
View full text
Download PDF
Q&A
Copyright: © 2025 The Authors; exclusive licensee Bio-protocol LLC.
引用格式:杨宇章, 陈锡祥, 徐见容. (2025). 基于Dual进样模式的中药来源活性小分子与靶标互作的异位协同表征. // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011021. DOI:
10.21769/BioProtoc.1011021.
 How to cite:
How to cite: Yang. Y. Z., Chen, X. X. and Xu, J. R. (2025). Dual Injection Mode-based Characterization of Allosteric Synergistic Interactions between Target and Bioactive Small Molecules from Traditional Chinese Medicine. // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011021. DOI:
10.21769/BioProtoc.1011021.
