摘要: 高通量筛选是早期药物研发不可或缺的一环,约一半以上获批药物的苗头化合物都源自高通量筛选。在创新药物研发过程中,针对靶蛋白寻找合适的配体分子是合理药物发现的重要步骤。本文基于高灵敏度、经典的分子互作技术-表面等离子共振(Surface Plasmon Resonance,SPR),通过高通量筛选高效发现能与靶标蛋白相互结合的活性小分子苗头化合物,利用该方法筛选出的小分子都能在后续功能实验得到验证。文中详尽介绍了高通量筛选体系的建立以及筛选实施的完整流程和步骤。该案例可为从事早期创新药物研发的科研人员提供有价值的参考。
关键词: 高通量筛选, 表面等离子共振技术, 小分子化合物, 创新药物研发, 实验流程
研究背景
生物分子间的相互作用是生命活动的基石,分子间结合的特异性、强弱、快慢等都是生命科学研究的重要内容。随着检测通量和灵敏度的提高,生物物理技术已成为研究生物分子互作的重要组成部分。表面等离子体共振(Surface Plasmon Resonance,简称SPR)技术是其中最广泛使用的一种。表面等离子共振(SPR)是经典的光学物理现象,从发现并被运用到生物医药领域已有数十年时间。作为分子互作的金标准,表面等离子共振目前已先后被美国药典、日本药典及中国药典纳入。
表面等离子共振(SPR)技术是一种基于光学原理发展而来的新型分析技术。是指光在棱镜与金属膜表面上发生全反射现象时,形成消逝波进入到光疏介质中,而在介质(假设为贵重金属)中又存在一定的等离子波,在基于能量守恒的前提下两种波段相遇时可能会发生的共振现象。该技术可以检测抗原与抗体、DNA与蛋白、DNA与DNA之间的相互作用,其优势包括无需标记、无分子量限制以及能够检测低亲和力相互作用等,现已广泛应用于生命科学、医学诊断、食品安全及环境检测等领域。
科研人员发现了一个新的疾病治疗靶标蛋白A,为了研究该靶标可能的功能以及针对该靶标开展小分子药物研发,中国科学院分子细胞科学卓越创新中心化学生物学技术平台利用分子互作金标准-SPR技术,基于Biacore 8K仪器的高通量性能,针对美国食品药物监督管理局FDA批准药物库以及临床候选药物库,为该项研究开展了大规模筛选。帮助研究人员发现了可与靶标蛋白A直接结合的活性小分子,为后续深入研究该靶标蛋白功能以及相应创新药物研发提供了全新的思路。
材料与试剂
- 100% DMSO溶解的高浓度化合物96孔板(Corning公司,货号:3879)
- 适配Biacore 8K仪器的筛选所用384孔板(MICROPLATE, 384 WELL, PP, F-BOTTOM Greiner BIO-ONE公司,货号:781201)
- 适配Biacore 8K仪器的384孔板封膜(Microplate Foil 384-well,GE Healthcare公司,货号:BR-1005-77)
- 适配Bravo仪器的70 μL量程移液吸头(Fluotics公司,AGI-70 I ST)
- CM7 芯片
仪器设备
- BiacoreTM 8K SPR system系统(美国Cytiva公司)
- 自动移液工作站Bravo仪器(美国Agilent公司)
- MultidropTM Combi 小型自动分液仪(美国Thermo Scientific公司)
- 蛋白质稳定性分析技术(Nano DSF)PR.48仪器(德国Nano Temper公司)
- 离心机Centrifuge 5810R(德国Eppendorf公司)
- 微孔板振荡器ORBITAL SHAKER MX100-4A(CHINCAN公司)
实验步骤
一、高通量筛选体系的建立和筛选实施
高通量筛选总流程
众所周知,表面等离子共振(SPR)技术是一种无标记、高灵敏度的分子间相互作用检测技术。基于该技术原理的Biacore 8K仪器具备高通量检测性能,可在一次操作中实现无人值守检测四块384孔板共1536个样品分别与固定在芯片上配体的结合情况。 Biacore 8K仪器尤其适合针对无确定功能的靶标蛋白筛选可与其直接结合的小分子或者生物大分子等。以筛选靶标蛋白互作小分子化合物为例,图1展示了中国科学院分子细胞科学卓越创新中心化学生物学技术平台创建的利用Biacore 8K仪器发现与靶标蛋白互作小分子化合物的高通量筛选完整流程。
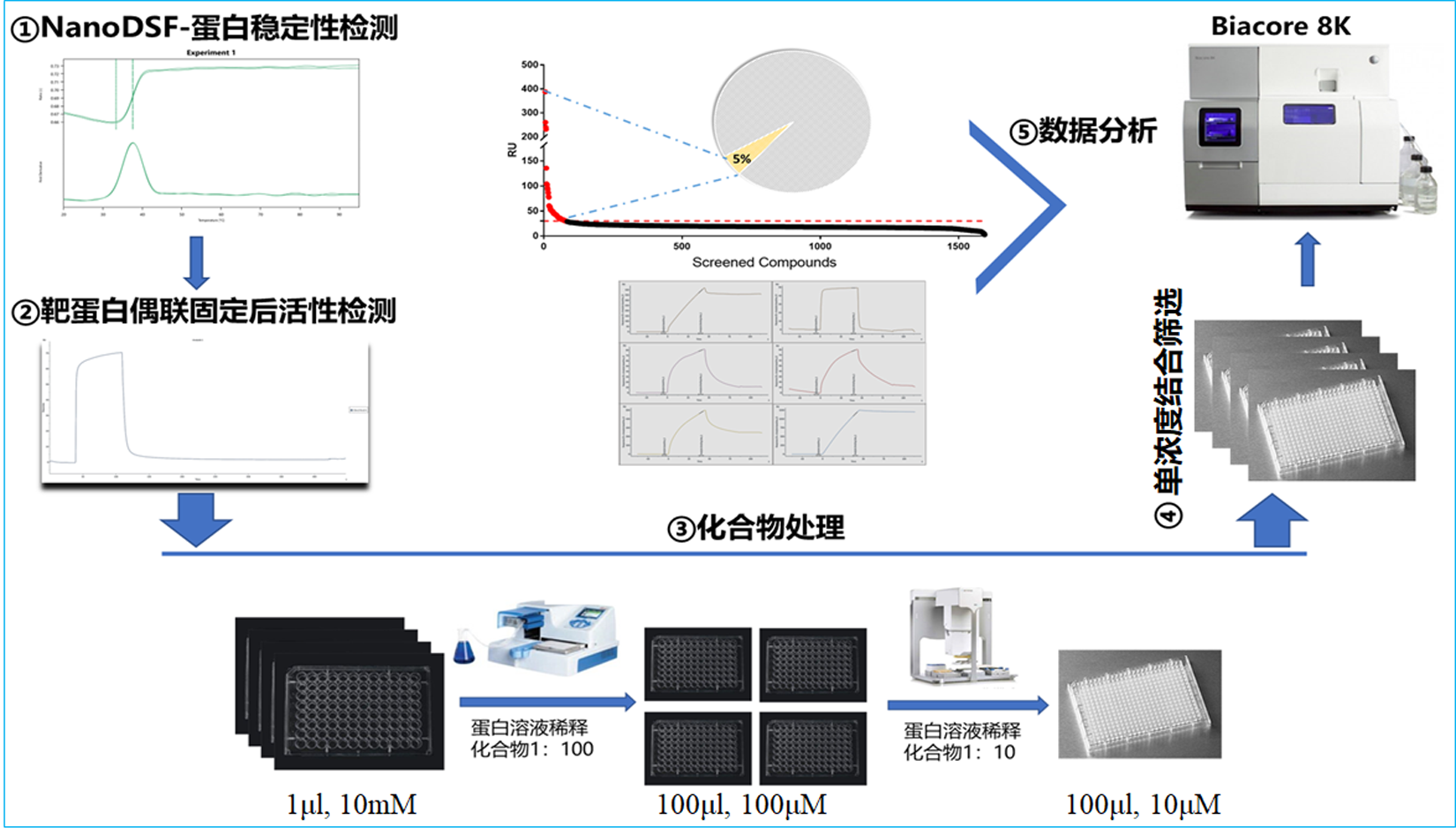
图1 利用SPR技术发现与靶标蛋白互作小分子化合物的高通量筛选流程图
- 通过蛋白稳定性评估来确定SPR高通量筛选时合适的条件。例如:实验运行缓冲液类型;实验温度;实验总时长;待筛选小分子化合物浓度阈值。蛋白稳定性评估实验采用了德国NanoTemper 蛋白质稳定性分析技术(nanoDSF)PR.48仪器来完成。在蛋白稳定性评估过程中,通过检测不同缓冲液中靶标蛋白的熔解温度Tm值的变化来选择相对更能稳定蛋白结构的缓冲液作为筛选运行缓冲液;将靶标蛋白分别处于常温25 ℃以及15 ℃两种不同温度环境,并分别放置不同时长,例如10小时、18小时、26小时等条件处理后,检测各条件下靶标蛋白Tm值,以此确定筛选实验温度以及实验总时长;同样,根据靶标蛋白热稳定性变化即Tm值的变化来检测靶标蛋白对于不同浓度DMSO的耐受程度,并由此结果来确定待筛选小分子化合物浓度上限。以上各实验条件的确定即为Biacore 8K仪器在筛选时的合适工作条件。在该类筛选体系中,需要准备600 μg–900 μg蛋白量,蛋白浓度不低于1 mg/mL,蛋白溶液为非Tris-HCl缓冲液,且纯度不低于90%的靶标蛋白即可开展大规模筛选。
- 在开展SPR筛选前,验证偶联在芯片上靶标蛋白的活性。在该SPR筛选实验中,选择靶标蛋白为配体,通常以可获得配体偶联量最多的氨基偶联方法来进行配体偶联并固定在S系列芯片表面。利用已知的可与靶标蛋白发生相互作用的生物分子比如小分子化合物、多肽或者蛋白来验证固定在仪器芯片上的配体靶标蛋白是否具有结合活性。若在该步未能如预期检测到相互作用的结合信号,则需更换配体蛋白的偶联方式以及相应芯片,例如采用链霉亲和素SA识别生物素标记的靶标蛋白这种捕获法来固定靶标蛋白,以充分保证被固定的靶标蛋白的结构活性。生物素标记蛋白的方法有随机标记以及定向标记两大类,在该筛选系统中,为了保证靶标蛋白在被SA捕获之后能维持正常的结构构象,需选择定向生物素化Avi标签的靶标蛋白。在正式筛选之前,只有在确认固定在仪器芯片上靶标蛋白具有活性的基础上才可启动后续的筛选步骤。
- 通量化处理待筛选化合物库。为了充分保证筛选时化合物的活性,需在筛选当天来处理待筛选化合物,不宜提前操作。在该筛选体系中,待筛选化合物库被分装在聚丙烯PP材质的96孔板中。1 μL、10 mM 100% DMSO溶解的单体化合物被分别放置在96孔板各孔中,每孔单独放置一种单体化合物。利用Thermo Fisher公司小型自动分液仪Multidrop Combi以及Agilent公司自动移液工作站Bravo仪器来对化合物库进行两步稀释以及转板到Biacore 8K仪器适配的PP材质384孔板中,待上机后即可开展筛选。在化合物库稀释过程中,选择不含DMSO的Biacore 8K仪器运行缓冲液来稀释10 mM 100% DMSO溶解的单体化合物,该体系化合物筛选浓度均为10 μM。每块化合物样品板都需设置0.1% DMSO样品作为阴性对照,而且处理好的化合物样品板需即刻进行封膜处理以免因挥发导致孔内化合物浓度不均匀产生怪异的结合信号。
- 利用Biacore 8K仪器开展单浓度结合筛选。该筛选体系中,待筛选化合物作为分析物依次流经芯片上配体表面并产生相应的结合信号。在结合筛选之前,需进行Clean Screen操作即让每个待筛选化合物都分别流经还未偶联配体蛋白的芯片表面,以去除那些非特异性吸附特别明显的化合物,以免这些“粘性”化合物在单浓度结合筛选过程中对同通道其它化合物的结合信号产生干扰,导致假阳性或者假阴性筛选结果。Clean Screen之后,对芯片表面进行再生处理后即可开展单浓度结合筛选。
- 筛选数据的分析。在该筛选体系中,每个样品在解离前5秒结合曲线所对应的共振单位RU值为其筛选信号。在选择阳性化合物时,根据所有DMSO阴性对照样品的筛选信号的平均值以及标准方差来产生选择阈值。筛选信号高于选择阈值且不超过对应Rmax值5倍,其结合解离传感曲线行为正常的化合物即为筛选所得阳性化合物。该类筛选阳性率在5%左右,通过对阳性化合物已有的作用机制归类发现此类筛选通常会筛选出一系列作用机制相同的化合物。这一现象充分验证了该类筛选系统的可靠程度。
二、SPR高通量筛选详细步骤 - 筛选前准备工作
- 缓冲液的准备:所有缓冲液都需在实验当天经0.22 μm滤膜过滤后方可使用。
(1) 用来稀释高浓度化合物的缓冲液Buffer-A,同时也是靶标蛋白在Biacore 8K仪器上进行偶联时所需的运行缓冲液的准备。用来稀释高浓度化合物的缓冲液所需准备总量为:[(N+1)* 10 + 42 * N/4 + 7 ] mL, 其中N为储存高浓度化合物库96孔板数。靶标蛋白偶联时所需的Biacore 8K仪器运行缓冲液总量为:1 L。
(2) 化合物分步稀释时DMSO对照样品所需的缓冲液Buffer-B的准备。该缓冲液为含1% DMSO的Buffer-A,其所需准备总量为:(N*2 + 7)mL, 其中N为储存高浓度化合物库96孔板数。
(3) Biacore 8K仪器高通量筛选时所需运行缓冲液Buffer-C的准备。该缓冲液中DMSO含量为0.1%,其所需准备总量为:2.1 L。 - 耗材的准备:
(1) Biacore 8K仪器适配的PP材质384孔板,其所需准备量为:N/4 块。其中N为储存高浓度化合物库96孔板数。实验前需对各孔板进行编号标记。
(2) Biacore 8K仪器适配的384孔板封膜,其所需准备总量为:N/4 张。其中N为储存高浓度化合物库96孔板数。
(3) 化合物稀释所需Agilent公司自动移液工作站Bravo仪器所需的70 μL量程移液吸头,其所需准备总量为:N/4 盒。其中N为储存高浓度化合物库96孔板数。
(4) SPR实验所需芯片以及试剂的准备。该筛选体系中所选择芯片为偶联量高的S系列CM7芯片。根据配体蛋白稳定性以及待筛选化合物库的规模来确定所需芯片数量,可先准备2张。同时,确认氨基偶联所需试剂是否足量。
(5) 各种量程的移液枪一套以及无菌枪头:蓝枪头两盒;黄、白枪头各三盒。
(6) 50 mL、15 mL、1.5 mL无菌离心管各一包。
(7) 2 L体积玻璃蓝盖瓶 2个。 - 仪器的准备:
(1) 用来进行化合物稀释的Agilent公司自动移液工作站Bravo仪器程序的准备。至少提前一天编辑所需的程序并进行预运行,确保筛选时程序的可行性。
(2) 用来进行化合物稀释的Thermo Fisher公司小型自动分液仪Multidrop Combi仪器的准备。在该筛选体系中,选择标准分液盒来进行化合物稀释;通过注射器反推无菌ddH2O方式保证分液盒喷头出液顺畅;准备清洁分液盒管道的各溶S液各500 mL。 - 操作人员的准备:该筛选实验至少需要2位工作人员的全程参与。
- 筛选化合物的制备:化合物筛选终浓度为10 μM。
- 使用Multidrop仪器将10mM高浓度化合物稀释至100 μM:
实验当天从-20 ℃冰箱取出分装在PP材质96孔板中的化合物库,于室温避光融解15分钟后室温离心(129× g 2min)。每块96孔板中化合物排布如图2所示。化合物库融解的同时准备好Multidrop仪器至可操作状态。去除每块化合物储存板上热封膜后放置在Multidrop仪器板架上,往对应孔中加入100 μL Buffer-A,将对应孔10 mM 100% DMSO溶解的单体化合物稀释至100 μM。用Multidrop往每块化合物板Column1和Column12中加入Buffer-B,每孔100 μL。稀释后的化合物板放置在微孔板震荡器上充分混匀:转速400 RPM,时长10分钟,避光操作。震荡化合物板的同时,用Multidrop仪器往Biacore 8K仪器适配的PP材质384孔样品板各孔中加入90 μL Buffer-A,为下一步稀释作准备。
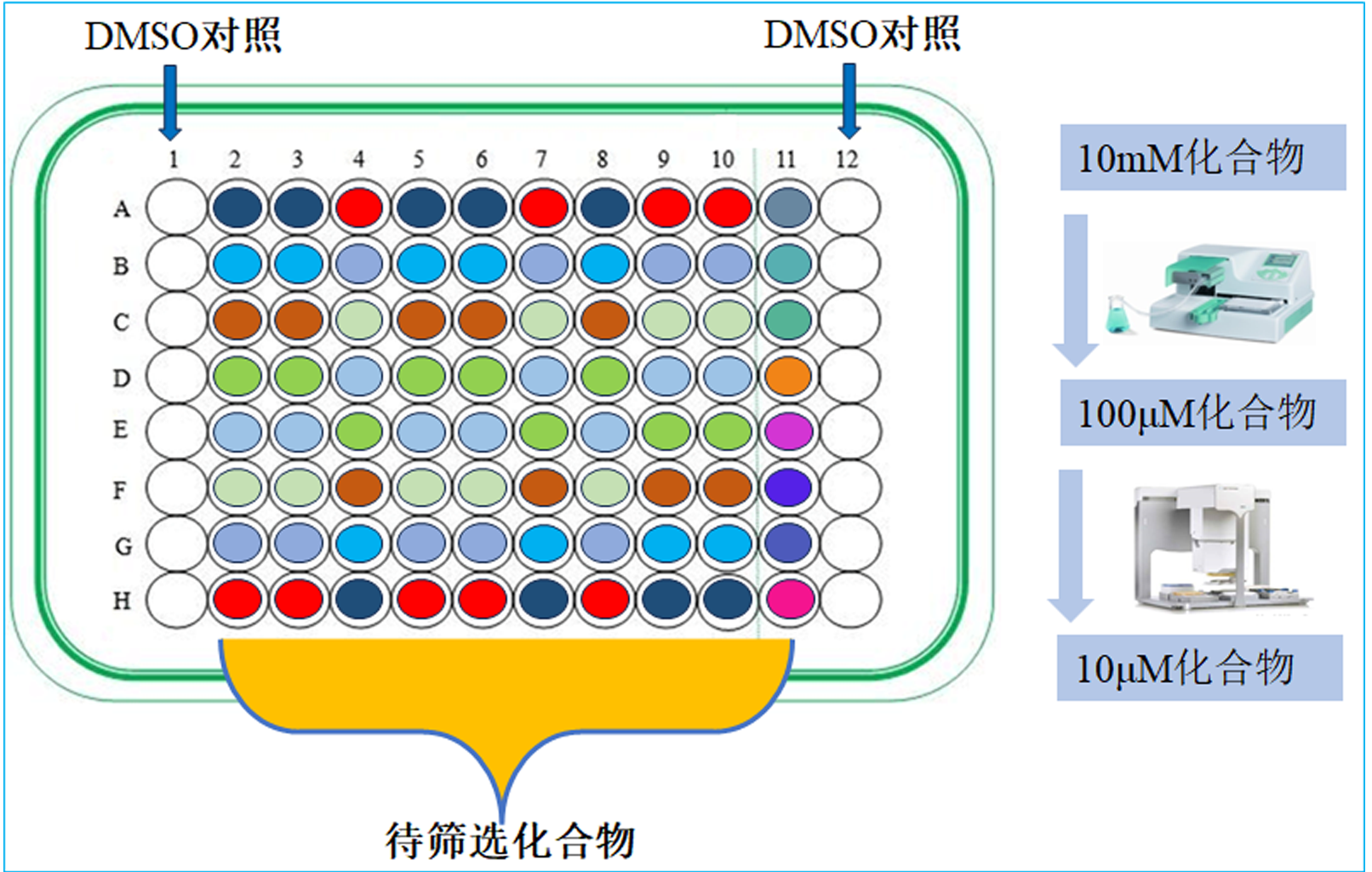
图2 96孔化合物库板中化合物排布以及化合物稀释过程
- 使用Bravo仪器将100 μM中转浓度化合物稀释至终浓度10 μM:
将以上加入Buffer-A的384孔板于室温离心(129× g 2min)后,放置在Bravo仪器程序设定所对应的板位上。利用Bravo-96ST 移液头从96孔化合物板各孔中取10 μL,100 μM化合物移液至384孔板各对应孔90 μL Buffer-A中,经70 μL 量程tips 8次吸吹充分混匀后,室温离心(129× g 2 min),封好384孔可穿透粘性膜待用。每4块96孔化合物板按对应位置排布转板至1块384孔板中,制备成最终的筛选上机样品板。Bravo仪器程序中孔板位置排布及其VWorks操作软件程序设置分别如图3和图4所示。
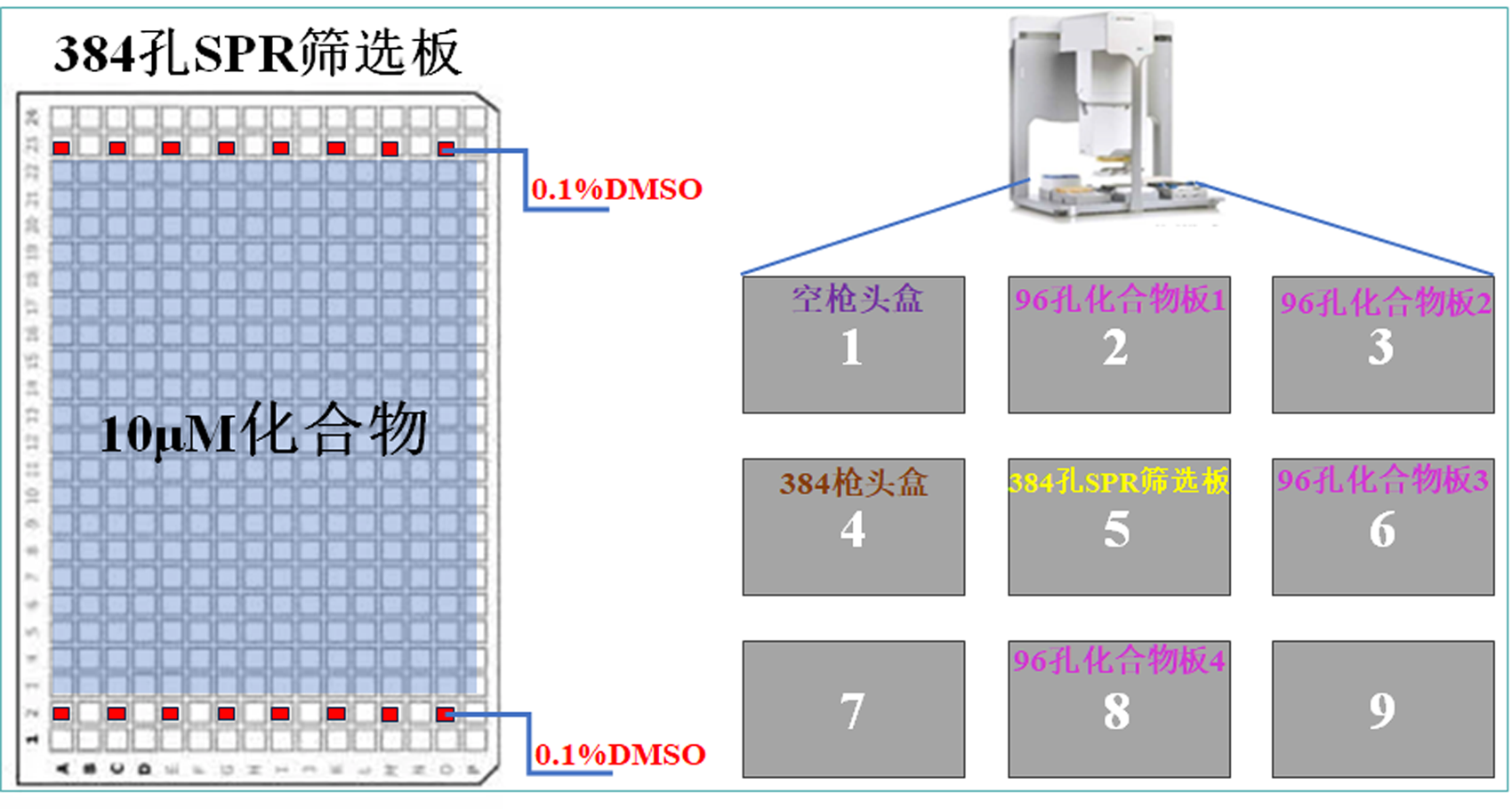
图3 384孔SPR筛选板排布以及Bravo仪器板位排布
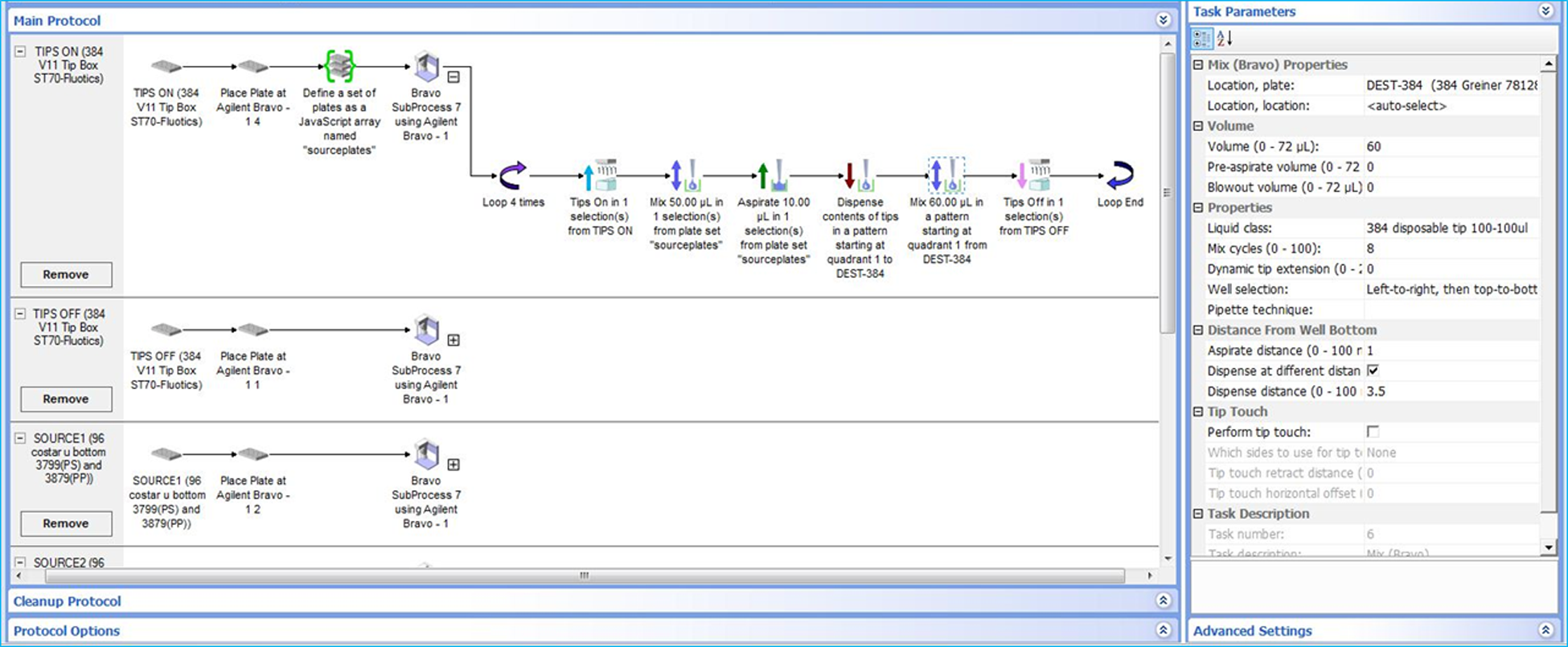
图4 Bravo仪器VWorks操作软件中化合物稀释程序设置
- 同法复制一套终浓度为10 μM的待筛选化合物库,以备Clean Screen以及单浓度结合筛选两次实验所需。
- Clean Screen
- Biacore 8K仪器流路系统环境的准备。Biacore 8K仪器可将S系列芯片分隔为8个通道(Channel),即一次实验最多可检测8对分子间相互作用。在仪器上安装好对应芯片之后,将Biacore 8K仪器右外侧标记为“Buffer”以及“Reagent”两根管道插入体积为1 L的运行缓冲液Buffer-A中。点击仪器操作软件控制面板中“Change Solutions”任务后,点击“Ready to Start”即可用现有运行缓冲液更换仪器中原有液体环境。为了将管路系统中原溶液更换彻底,可重复操作“Change Solutions”任务三次,每次耗时6分钟,消耗约200 mL运行缓冲液。该步操作如图五所示。
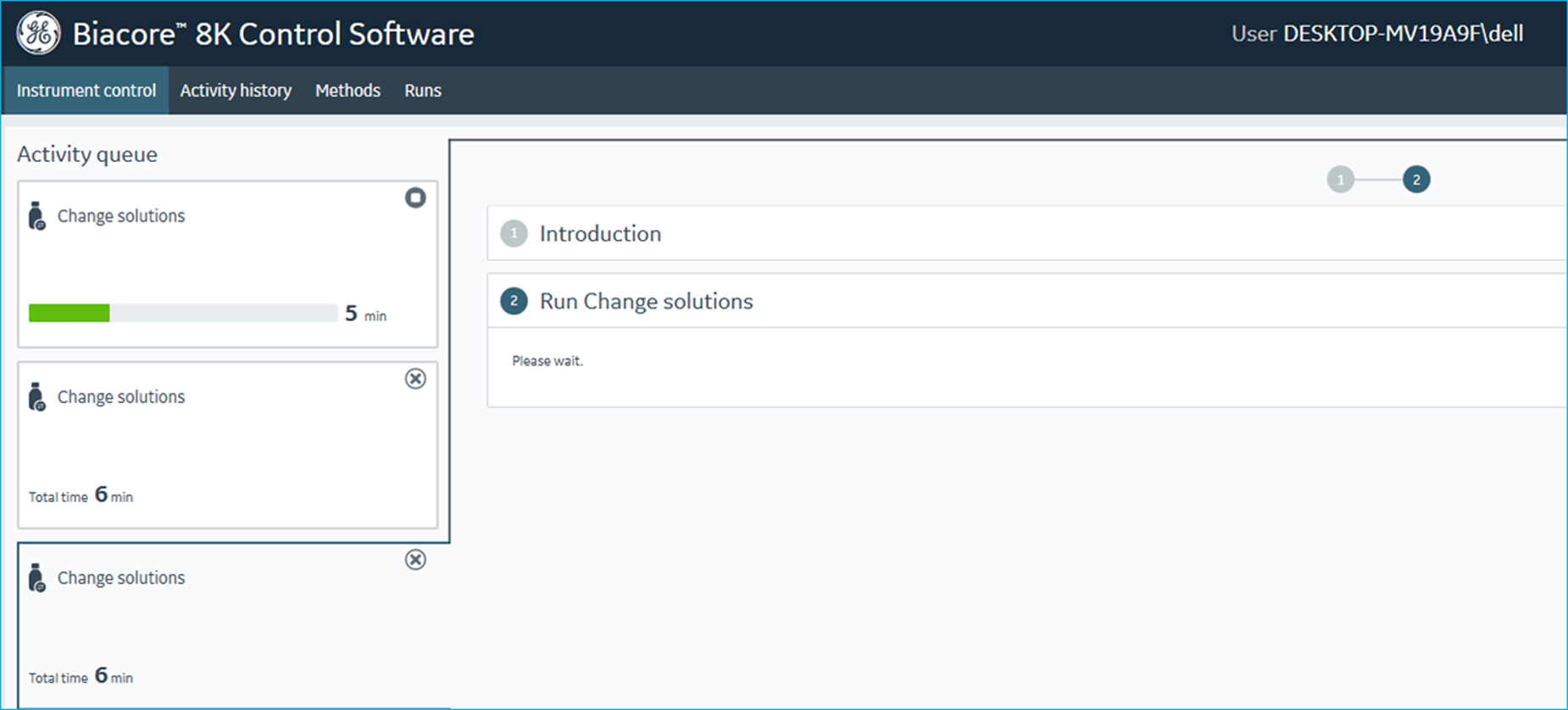
图5 Biacore 8K仪器控制软件中“Change Solutions”操作界面
- Clean Screen。按序取4块已封膜且作标记的384孔化合物筛选样品板分别固定在Biacore 8K仪器对应样品板架上,放置在Biacore 8K仪器内上下两层样品舱中。Biacore 8K仪器将按照图六所示实验方法自动进样开展Clean Screen。待该轮筛选结束,可及时放置下一轮筛选样品进行Clean Screen,直至所有化合物都完成筛选。
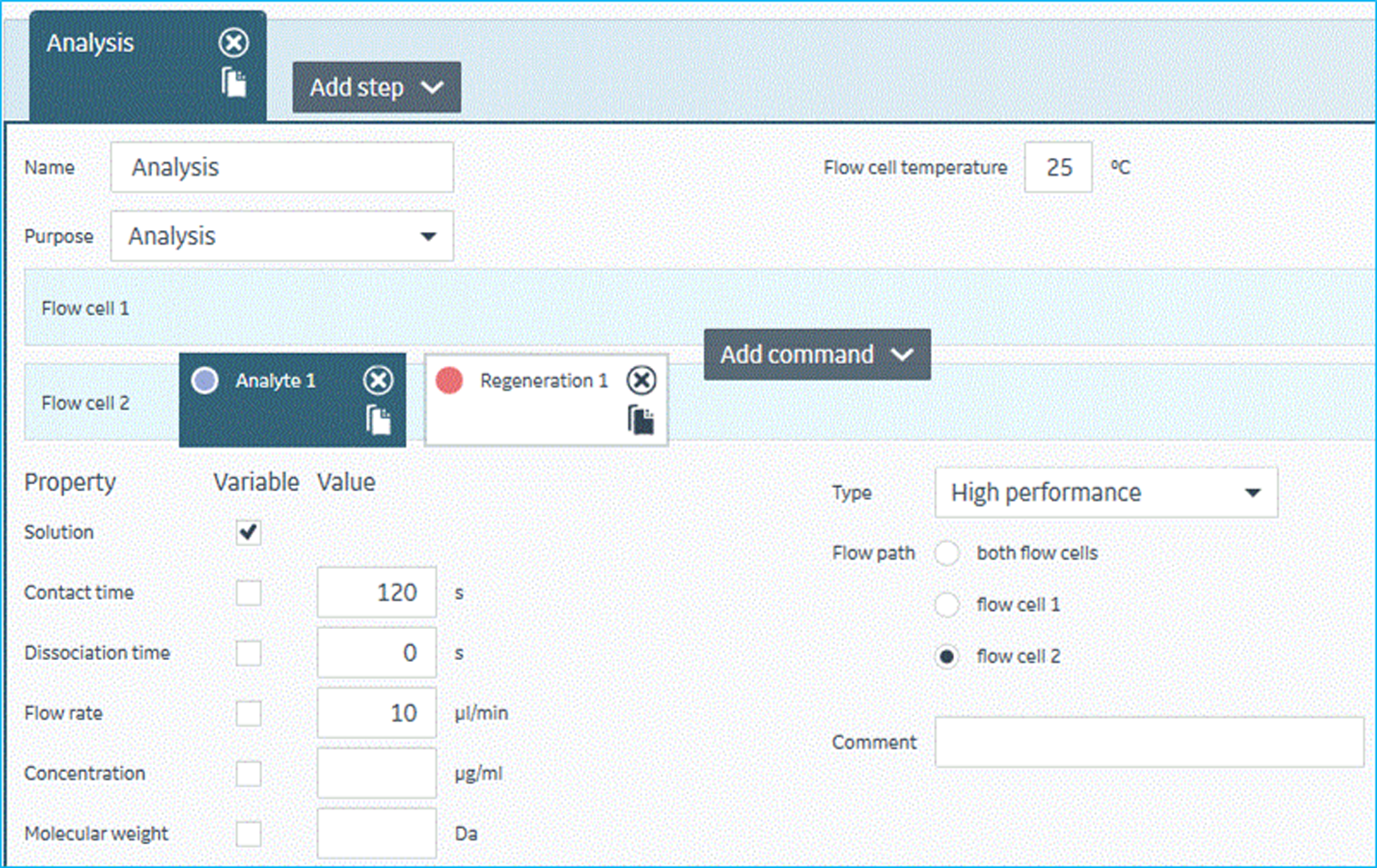
图6 Biacore 8K仪器控制软件中“Clean Screen”实验方法设置
- Clean Screen结果分析和“粘性化合物”的处理。如图7所示,根据Biacore 8K仪器Insight Evaluation Software分析软件中“Fragment Clean Screen”分析模块来选择超过阈值的“粘性化合物”。从Clean Screen实验方法中查找“粘性化合物”所对应的板孔位,并对应去除单浓度结合筛选的化合物库中同板孔位的“粘性化合物”,同时补充相同体积的运行缓冲液Buffer-C于该孔中。由于待筛选化合物样品板已封膜,该步操作可采用注射器针头抽液去除和注射换液方式来完成。Clean Screen结束之后,通过NaOH对芯片进行再生。
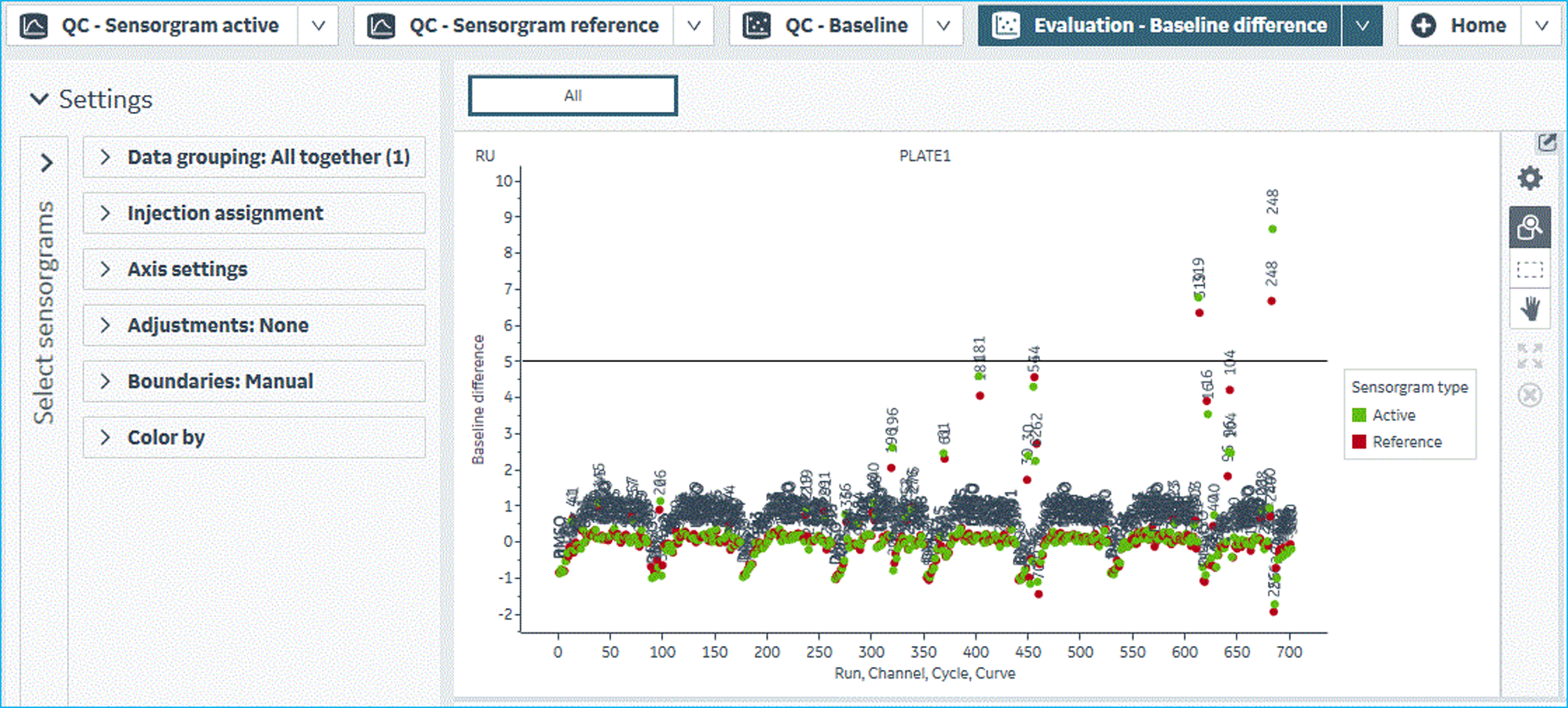
图7 Biacore Insight Evaluation Software分析软件中“Clean Screen”分析结果展示
- 靶标蛋白的偶联:该筛选体系选择氨基偶联方式将配体靶标蛋白固定在CM7芯片上。
- pH Scouting-配体靶标蛋白预富集条件摸索。用不同pH值(pH 5.5、pH 5.0、pH 4.5、pH 4.0)醋酸钠溶液分别稀释配体蛋白至200ug/ml浓度,该步稀释比例不要低于1:5。稀释比例越高越容易保证配体蛋白带上对应的正电荷量,以便其通过静电吸附在芯片表面,有利于配体靶标蛋白后续进行充分的氨基偶联反应。pH Scouting实验中可使靶标蛋白产生最高偶联量的条件即为筛选所需条件。该步实验过程如图8所示。
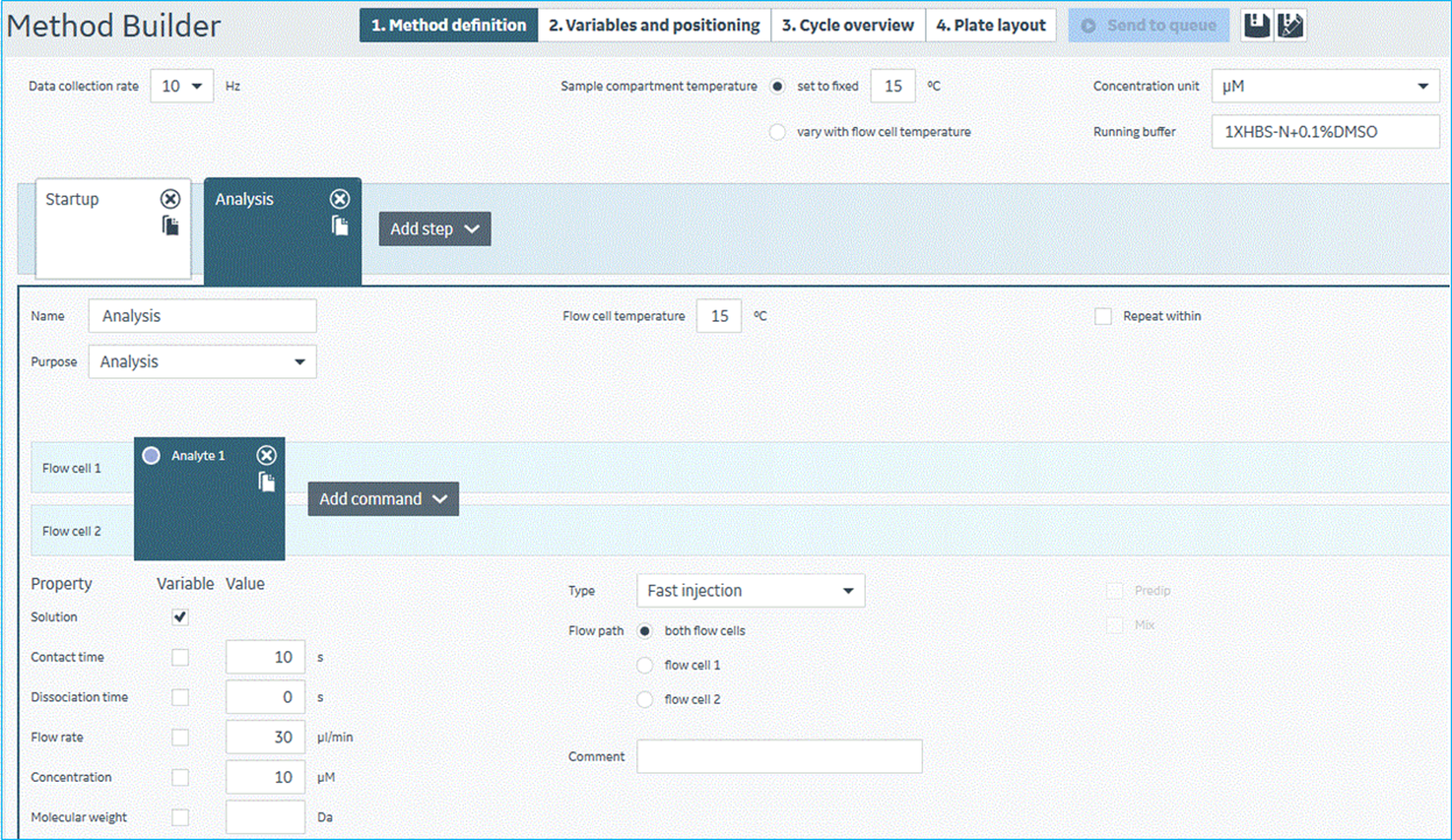
图8 Biacore 8K仪器控制软件中,pH Scouting实验方法设置
- 配体靶标蛋白的偶联固定。为了产生尽可能高的偶联量,该筛选体系中活化剂(EDC/NHS)作用芯片表面时长为600秒,靶标蛋白氨基偶联反应时长为900秒,乙醇胺封闭剂作用时长为600秒。实验中,靶标蛋白均被氨基偶联在芯片各Channel 的样品通道Flow Cell2上。为了防止手动加样过程中液滴飞溅影响各试剂的性能,在96孔样品板排布中,需将封闭剂与活化剂间隔开。活化剂需提前分装好,避免使用反复冻融的活化剂。而且,活化剂以及封闭剂在制备过程中应在冰上操作以充分保证试剂活性。该筛选体系中,配体的氨基偶联均在25 ℃下进行。该步实验过程如图9所示。若靶标蛋白含有大的标签蛋白例如:GST-tag、MBP-tag、SUMO-tag等,需要在实验前通过酶切等方式去除这些大的标签,纯化后再进行偶联。针对无法去除大的标签蛋白的靶标蛋白,可将对应的标签蛋白本身即GST、MBP、SUMO等按照和靶标蛋白相同摩尔数以及相同pH值醋酸钠溶液条件下,氨基偶联在芯片各Channel的参比通道Flow Cell1上。在单浓度结合筛选过程中,每个分析物会分别流经对应Channel 中Flow Cell1以及Flow Cell2表面,并产生相应的响应。Flow Cell2表面的响应值扣减掉Flow Cell1表面响应值即为分析物与靶标蛋白本身相对真实的相互结合信号。
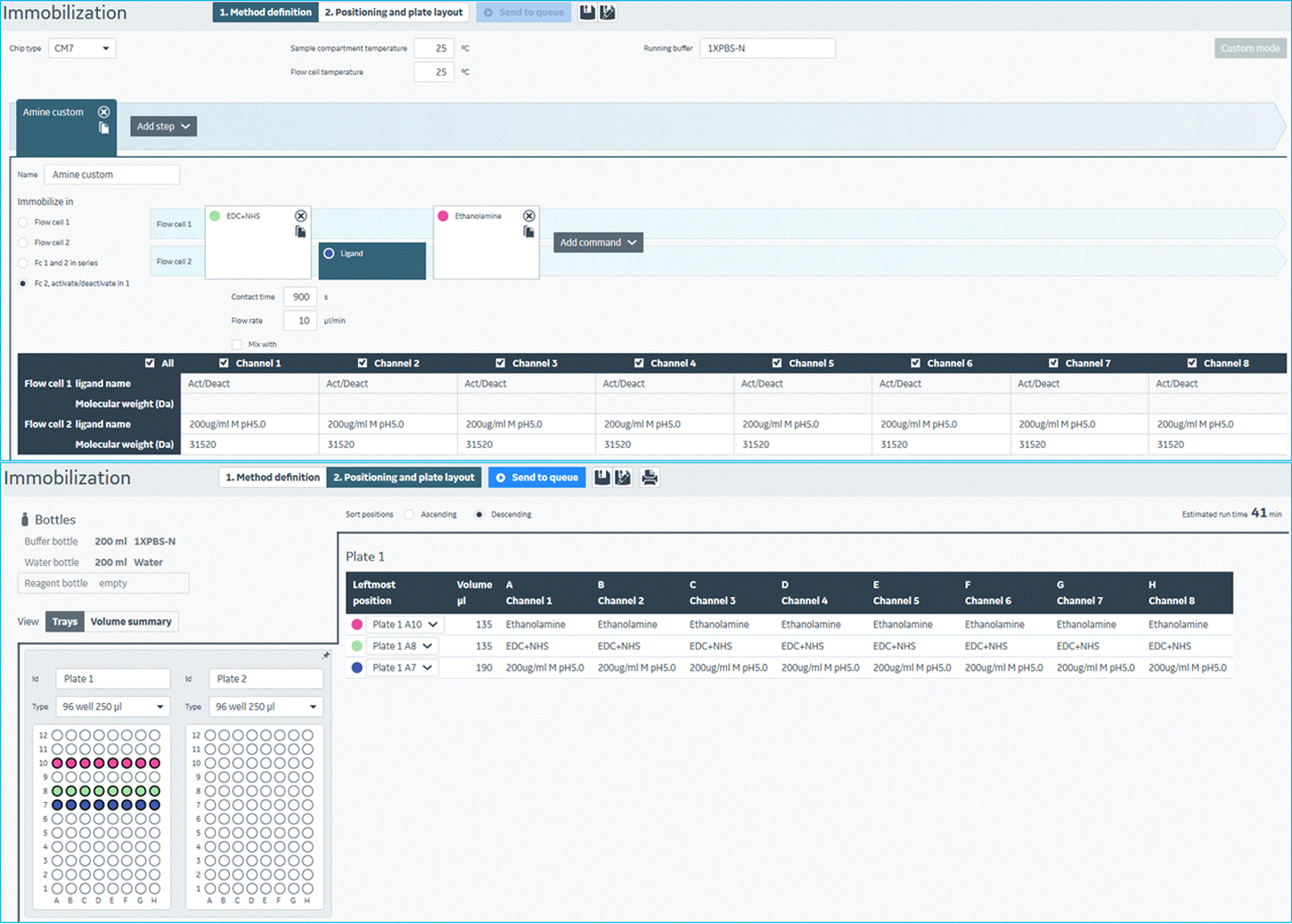
图9 Biacore 8K仪器控制软件中,氨基偶联固定配体蛋白实验方法设置
- 基线的稳定。在靶标蛋白氨基偶联结束后,需要将没有偶联上以及偶联不牢固的靶标蛋白从芯片表面冲洗下来,以使系统基线平稳。该步需要至少6个循环才可获得较稳定的基线,其实验过程如图10所示。
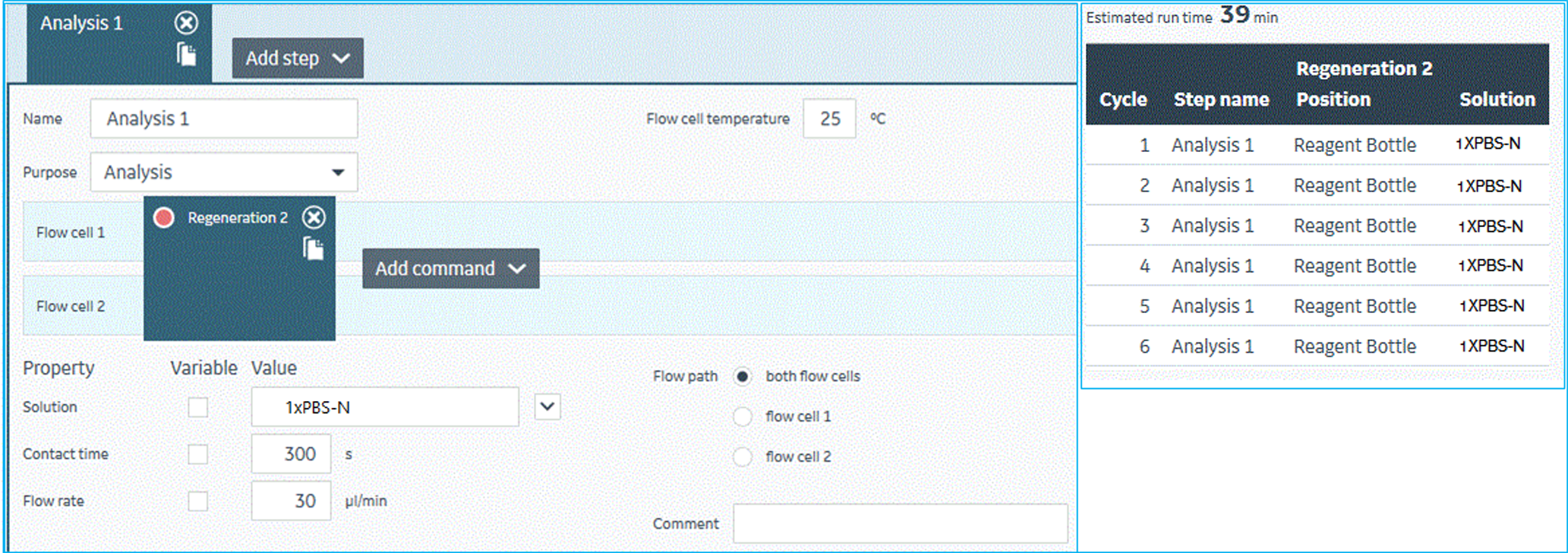
图10 Biacore 8K仪器控制软件中,稳定基线的实验方法设置
- 单浓度结合筛选: 该筛选步骤中,Biacore 8K仪器工作温度设置在15 ℃环境下进行。
- Biacore 8K仪器流路系统溶液即运行缓冲液的更换。为了尽可能减少溶剂效应,在单浓度结合筛选时,系统运行缓冲溶液要与10 μM化合物所在溶液保持一致,运行缓冲液需含有0.1% DMSO。即在单浓度结合筛选前,需将系统运行缓冲液更换为Buffer-C。运行缓冲液更换之后,需同上法进行“Change Solutions”操作三次,以充分保证 Biacore 8K仪器流路系统溶液一致性。
- 单浓度结合筛选。筛选时,需在每块样品板上设置足量的DMSO阴性对照。在设置好单浓度结合筛选的实验方法之后,将标记好的待筛选384孔化合物样品板固定并装载上机即可开展筛选。该筛选体系中,一次操作完成四块384孔板1280个样品的检测。根据化合物库的规模,开展相应轮次的上样检测即可完成整个筛选。该步实验过程如图11所示。
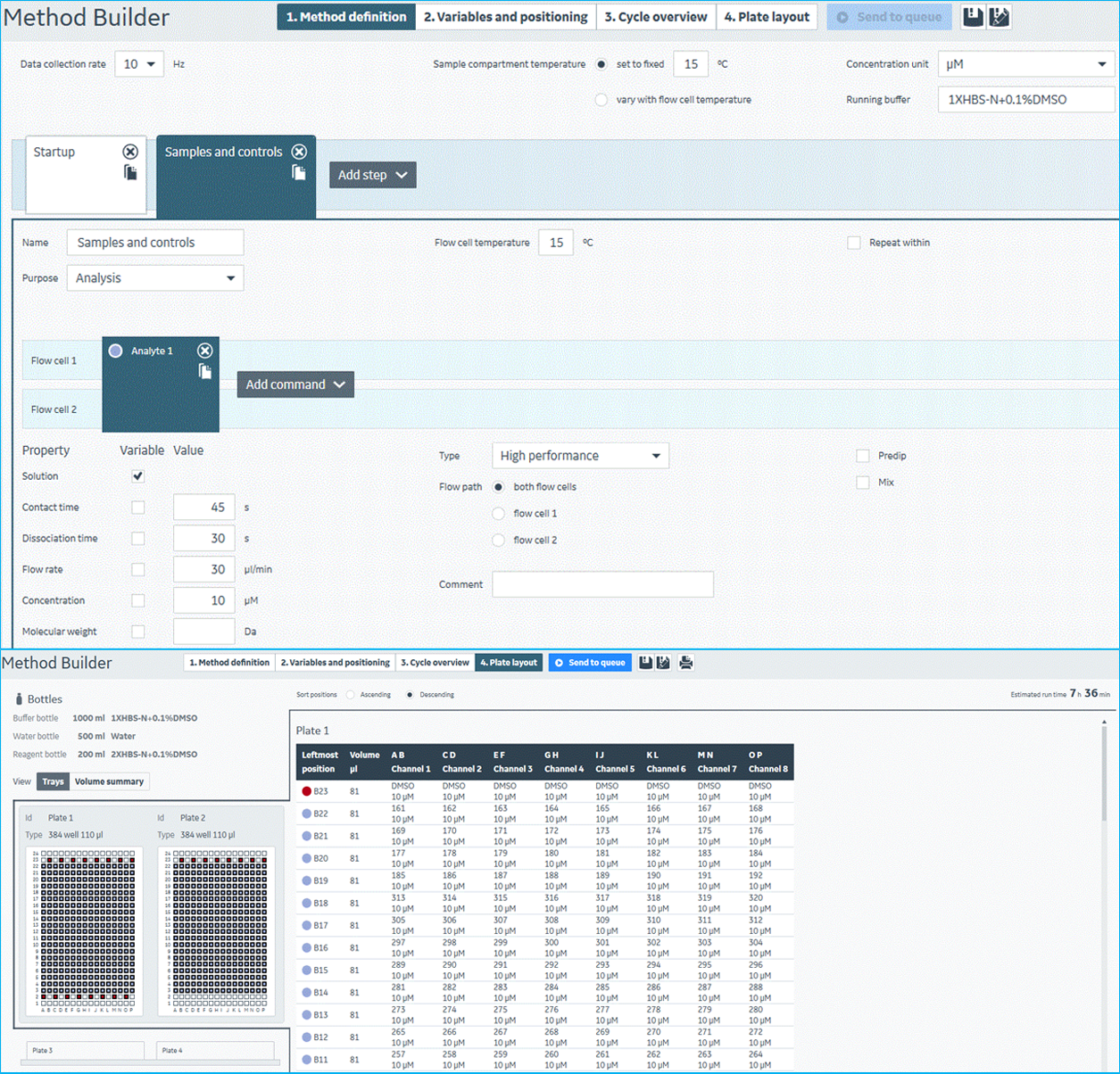
图11 Biacore 8K仪器控制软件中,单浓度结合筛选实验方法设置
结果分析
筛选结果由Biacore 8K仪器分析软件中Plot模式输出,其结果如图12所示。阳性化合物的选择阈值由以下公式来确定:Average RU of DMSO Control + 5* SD of DMSO Control。当化合物的结合RU值大于选择阈值,且不超过对应Rmax值的5倍,同时其结合解离传感曲线正常,则该化合物可被确认为筛选阳性小分子。经处理后,本次筛选结果如图13所示。该筛选系统所得阳性小分子化合物在研究团队后续的细胞水平功能验证中发挥了显著的作用,这些活性小分子可特异地抑制底物蛋白的甲基化水平(图14)。该功能验证结果充分体现了本筛选体系的可靠性。
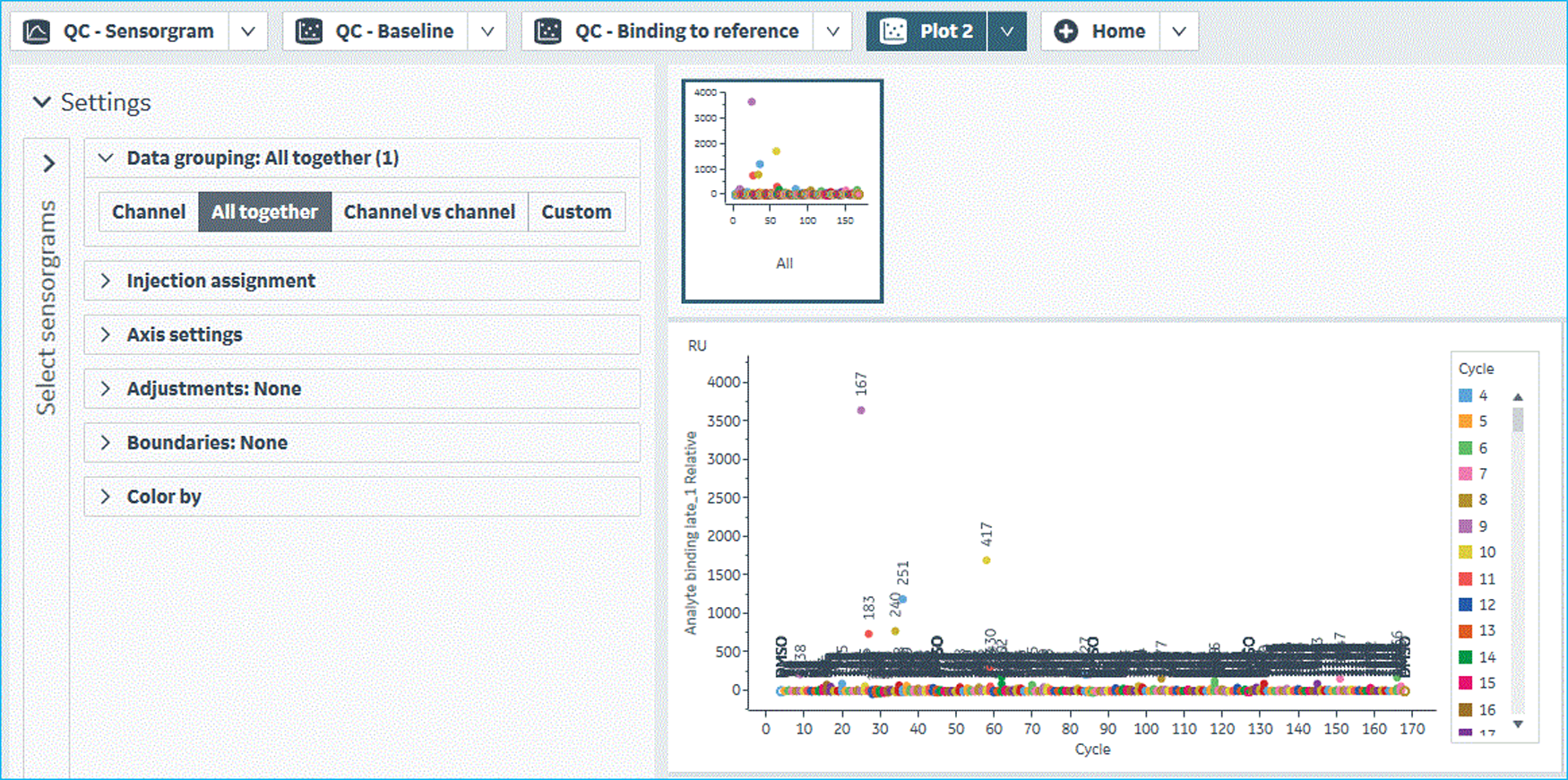
图12 Biacore Insight Evaluation Software分析软件中单浓度结合筛选点状图分析结果展示
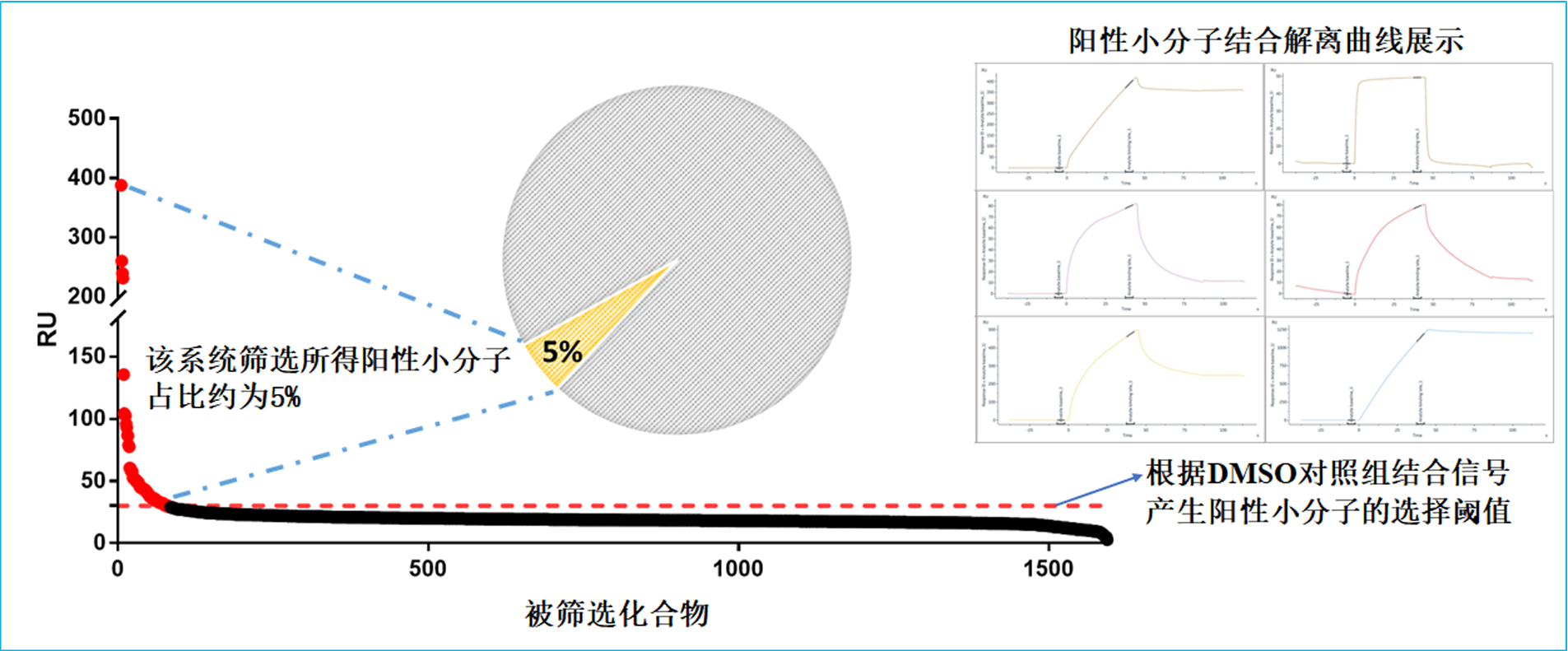
图13 利用该筛选体系所得筛选最终结果
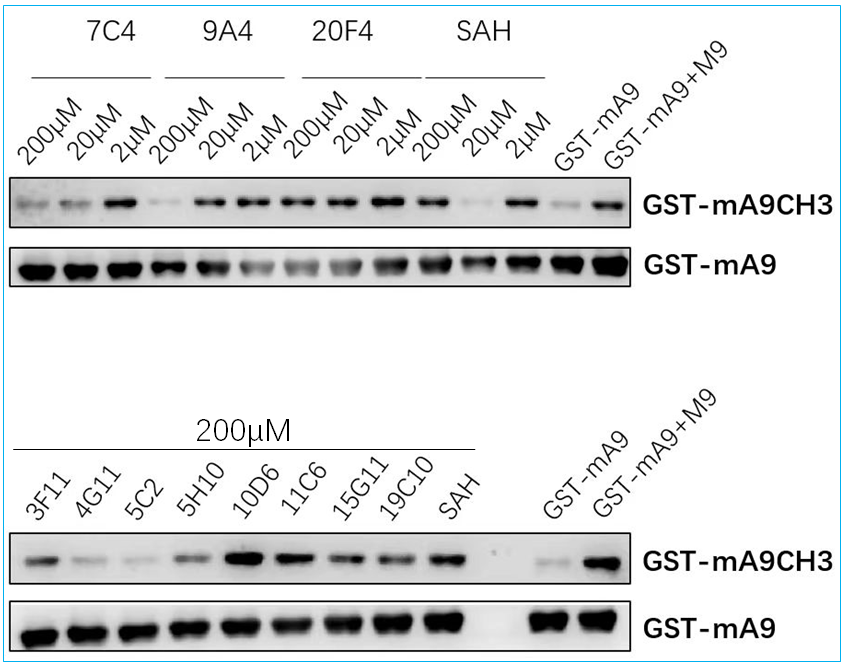
图14 筛选所得阳性小分子可特异抑制底物蛋白的甲基化水平
总结
本文详述了利用表面等离子共振技术高通量筛选可与靶标蛋白相互结合活性小分子的完整实验方案。该筛选体系操作便捷,借助Biacore 8K仪器的高灵敏度及其实时、动态检测模式可精准发现潜在的活性小分子。当靶标蛋白功能不明确时,运用该筛选体系可快速发现有价值的分子探针研究工具,并可推动后续相应创新型药物的开发。纵观近三十年来创新药物研发情况,超一半的药物靶标聚焦在各种蛋白酶上。在针对蛋白酶的早期药物研发过程中,通常利用各种酶促反应体系来开展生化水平的高通量筛选,通过初筛发现的酶活抑制剂或激动剂是否能够直接作用在靶标蛋白酶上,进而可利用本文所述的筛选体系来进一步确认,从中挖掘真正高潜力的苗头化合物。
相比其它分子互作筛选体系而言,基于SPR技术的高通量筛选体系主要缺点是其筛选成本相对较高。但其高灵敏度性能以及宽广的可适用范围是其它分子互作筛选体系目前未能超越的。
注意事项
在本文所述的筛选体系中,实验操作时充分保持待筛选化合物的活性对于筛选结果而言非常关键。化合物操作时需要注意以下几点:
- 注意全程避光操作。
- 由100%DMSO 溶解的化合物要存放在聚丙烯PP材质的孔板或者容器中,不能存放在聚苯乙烯PS材质容器中,否则100%DMSO会溶解PS材质导致一系列不良后果。实验中常用的PS材质容器有:细胞培养皿、细胞培养瓶、细胞培养多孔板等。
- 每次操作化合物时,应尽量缩短高浓度化合物暴露的时长,尽快完成操作。尽量在干燥环境下(例如在有空气净化的空间,打开风机)操作100%DMSO溶解的高浓度化合物。
- 在进行化合物稀释时:从DMSO相到水溶液相的稀释比例尽量不低于1:100,否则容易降低化合物在水溶液中的溶解度。在稀释单个化合物时,若1:100比例甚至更高比例稀释DMSO相的化合物都不能完全溶解于水溶液中的话,则可考虑先用DMSO ≤ 1:10比例稀释DMSO相的化合物,之后再用上法稀释DMSO相化合物。
在SPR实验方面需要注意的要点如下:
- SPR实验所需的各种溶液需充分混匀且无气泡,以免出现怪异传感曲线。一定要使用与Biacore 8K仪器相匹配的耗材来开展SPR实验。例如:96、384孔板裙边高度和Biacore 8K仪器的载板架卡扣高度要吻合,以使孔板放置平稳、牢固,避免仪器机械臂自动取板时出现故障导致实验失败。
- 操作Biacore 8K仪器外侧“Buffer”以及“Reagent”两根管道切换到不同运行缓冲液时,应用无菌ddH2O浸湿过的洁净无尘纸捏住管道外壁来切换溶液,避免手套直接操作,防止手套上污物粘附在管道上带入缓冲液中影响实验。
- SPR实验时,要充分保证仪器所在环境的温度和湿度恒定。在南方地区,很有必要在仪器所在空间配备除湿机。为了防止突然断电对Biacore 8K仪器产生损伤,仪器的电源要与续航能力半小时及以上的不间断电源UPS相连。
致谢
本实验方案得到自然科学基金重大研究计划集成项目92253301和重点项目22137007的经费支持。本案例中高通量筛选实验设计、系统建立以及筛选实施均由中国科学院分子细胞科学卓越创新中心化学生物学技术平台完成。感谢化学平台各位老师在项目实施过程中所提供的帮助。
参考文献
- 李杰. (2022). 实用药物化学[M]. 邓卫平, 唐赟译. 北京: 化学工业出版社, 2022.6
- Huang, X. and Cao, X. (2023). Innovative drugs bring continuous benefits to cancer patients. The Innovation Life. 1(3): 100043. https://doi.org/10.59717/j.xinn-life.2023.100043
- Shen, L. (2022). Anticancer drug R&D of gastrointestinal cancer in China: Current landscape and challenges. The Innovation. 3(3): 100249. https://doi.org/10.1016/j.xinn.2022.100249
Please login or register for free to view full text
View full text
Download PDF
Q&A
Copyright: © 2025 The Authors; exclusive licensee Bio-protocol LLC.
引用格式:刘伟, 谢华彬, 王烁英, 慈云青, 许超, 兰姝珏, 陈铭. (2025). 利用SPR技术高通量筛选蛋白互作活性小分子. // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011020. DOI:
10.21769/BioProtoc.1011020.
 How to cite:
How to cite: Liu, W., Xie, H. B., Wang, S. Y., Ci, Y. Q., Xu, C., Lan, S. J. and Chen, M. (2025). High-Throughput Screening for Small Molecules Interacting with Targeted Protein by SPR Technology . // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011020. DOI:
10.21769/BioProtoc.1011020.
