摘要: 目的:通过在光敏芯片上固定未经过修饰的石杉碱甲(Huperzine A,Hup A)以及使用SPR样品回收技术(SPR recovery)垂钓与Hup A具有相互作用的潜在靶标。方法:通过紫外活化将Hup A固定在光敏芯片上,使用纯的乙酰胆碱酯酶(AChE)验证SPR样品回收技术的可行性;使用总蛋白裂解液进行SPR回收,将回收的样品冷冻干燥浓缩,进一步进行WB、银染和质谱检测。结果:银染可检测到SPR样品回收得到的纯AChE;质谱鉴定中未能检测到Hup A的靶标AChE,但是鉴定到Thbs1和Tubb5等影响细胞增殖、分化和细胞程序性死亡相关的潜在靶标。结论:本文使用紫外产生自由基的原理将未修饰的Hup A固定在光敏芯片上,结合SPR 样品回收技术垂钓到Hup A的潜在靶标,方法可应用于寻找小分子的潜在作用靶标。
关键词: SPR, 靶标垂钓, 石杉碱甲
材料与试剂
- 光敏芯片 (Xantec,产品目录号: UVHC1000M)
- 石杉碱甲(MCE,产品目录号:HY-17387)
- 乙酰胆碱酯酶活性检测试剂盒(索莱宝,产品目录号:BC2025)
- 50 mM NaOH (泰坦生物, 产品目录号: 1310-73-2)
- Tris (泰坦生物, 产品目录号: 77-86-1)
- 三色预染蛋白(白鲨生物,产品目录号:BL742A)
- 4~20%梯度胶(碧云天生物,产品目录号:P0050A)
- 快速转膜液(碧云天生物,产品目录号:P0575-10L)
- 快速电泳液(碧云天生物,产品目录号:P0562-10L)
- Anti-AChE 抗体(生工生物,产品目录号:D194874)
- HRP-conjugated Goat Anti-Rabbit IgG(生工生物,产品目录号:D110058)
- HRP显影液(美仑生物,产品目录号:MA0186-2)
- 考马斯亮蓝染液R250(考染)(生工生物,产品目录号:6104-59-2)
- 快速银染试剂盒(银染)(碧云天,产品目录号:P0017S)
- BCA试剂盒(碧云天生物,产品目录号:P0012S)
- Pierce® IP Lysis Buffer (Thermo,产品目录号:87787)
- 1.5 mL离心管(Axygen,产品目录号:MCT-150-C)
- T25培养瓶(Thermo,产品目录号:156367)
- T75培养瓶(Corning,产品目录号:430641)
- 高糖DMEM培养基(上海源培生物,产品目录号:M211125)
- FBS(澳范,产品目录号:FBSKM0502)
- 青霉素链霉素(上海源培生物,产品目录号:F121107)
- L-丙氨酰谷氨酰胺溶液(上海源培生物,产品目录号:39537-23-0)
- 0.25% Trypsin-EDTA(1×)(Gibco,产品目录号:25200-072)
- 10× PBS(Cytiva,产品目录号:BR100672)
- 10× HBS-EP(Cytiva,产品目录号:BR100669)
- 1× HBS-EP(见溶液配方)
- Pierce® IP Lysis Buffer(见溶液配方)
- 1× PBS(见溶液配方)
仪器设备
- Biacore T200(Cytiva,产品型号:T200)
- 电泳仪电源(BIO-RAD,产品型号:PowerPacTM Basic)
- Amersham生物分子成像仪(Cytiva,产品型号: ImageQuantTM 800)
- 冷冻干燥机(宁波新芝生物,产品型号:SCIENTZ-12N)
- LED紫外线灯(深圳中联,产品型号:365 nm,10 W)
- 多功能酶标仪(BMG LABTECH,产品型号:PHERAstar FSX)
- 质谱(Thermo Scientific,产品型号:Orbitrap Fusion Lumos)
实验步骤
一、实验前的准备
- 配体的准备
称取石杉碱甲1.0 mg,加入825.4 μL DMSO配制成5 mM储备液。 - 待回收总蛋白裂解液的准备
- 使用T75细胞培养瓶培养肾上腺嗜铬细胞瘤细胞(HT22)、小鼠海马神经元细胞系(PC12)细胞,汇合度达到90%左右收取细胞;
- 弃去培养液,使用4℃预冷的PBS清洗3遍;
- 在冰上加入800 μL IP裂解液 [1],用细胞刮刀将细胞刮下转移至1.5 mL离心管,混匀;
- 在冰上放置10 min, 期间涡旋2次;
- 4℃, 13,000× g, 离心10 min;
- 弃沉淀物,取上清即为用于回收的总蛋白裂解液。
注: PMSF与AChE的活性位点结合 [2],可能会影响到Hup A与AChE的相互作用,因此提取总蛋白的裂解液中不适合含有PMSF,本实验不添加蛋白酶抑制剂并且需要一直保持在4 ℃环境中进行。
- Running Buffer的准备
1× HBS-EP溶液(见溶液配方)。 - 其它准备内容
- 乙酰胆碱酯酶活性试剂盒检测备选细胞中AChE活性(按照说明书操作进行)。
- Western Blot(WB)鉴定AChE。考染定性验证AChE。
- 取凝胶放入考马斯亮蓝染色液中,置于摇床上缓慢摇动,室温染色至凝胶的颜色和染色液的颜色非常接近,可以认为已染色充分。加入适量考马斯亮蓝染色脱色液,置于摇床上缓慢摇动,室温脱色4~24小时。期间更换脱色液2~4次,直至蓝色背景基本上全部被脱去,并且蛋白条带染色效果达到预期。拍照留存即可。
注:脱色期间可以在脱色液中加入一片吸水纸,可以使部分染料吸附在吸水纸上,加快脱色。另外,脱色时间过长也会导致蛋白条带的颜色变浅。
- 银染鉴定进行AChE定性验证(按照说明书操作进行)。
- 仪器准备
- 仪器开机进行常规维护后将缓冲液更换为MQ H2O进行系统冲洗,选择Tools-Prime;
- 将仪器左边的缓冲液更换为HBS-EP,芯片更换为光敏芯片,进行系统冲洗,选择Tools-Prime。
注:更换缓冲液或芯片都需要运行一次prime。
- Hup A的紫外固定(小分子配体的偶联)
- 选择并运行Run-manual run模式,使用HBS-EP进样60秒,等待30秒,运行3个循环,记录基线值;
- 退出光敏芯片,使用MQ H2O冲洗后再装载芯片,进行系统冲洗后重复步骤6a;
- 步骤6a-6b重复3次;
- 室温(25 ℃),打开LED紫外线灯预热10分钟;
- 退出光敏芯片;
- 使用PBS将Hup A稀释成200 μM,量取20 μL Hup A滴加在芯片表面。关闭LED紫外线灯,将芯片转移至紫外灯下,距离约2~3 cm,再打开紫外处理5分钟(图1;图2)[3–5];

图1 光敏芯片紫外固定装置

图2 用于装载紫外处理光敏芯片的托盘(基于CM5外壳改造)
- 紫外处理结束后,取出芯片,用PBS冲洗;
- 将处理后的芯片装载进仪器中,使用HBS-EP进行系统冲洗;
- 选择并运行Run-manual run模式,使用HBS-EP进样60秒,等待30秒,运行3个循环,记录基线水平。
- 退出光敏芯片,使用MQ H2O冲洗后再装载芯片,进行系统冲洗后重复步骤6i;
- 步骤6i-6j重复3次;
- 退出芯片,更换为Control组芯片,除不添加Hup A外其它处理与Hup A组相同。
注:为计算Hup A固定在芯片上的量,需要记录紫外处理前后基线变化,固定量=|(Hup A组紫外处理后基线均值-紫外处理前基线均值)|-|(Control组紫外处理后基线均值-紫外处理前基线均值)|;实验采用水溶性的反应体系,在紫外固定前需要检查Hup A是否有析出。 - 样品回收条件
使用20~50 μg/mL纯的AChE作为验证对象,测试SPR样品回收的流程以及确定再生条件。按照下述分析方法流程,进样样品为20~50 μg/mL纯的AChE,其余的实验条件不变,进行方法、流程以及再生条件的验证。同时结合使用银染实验作为验证,以确保回收实验的有效性。
注:需要确定蛋白的再生条件,以确保样品回收的有效性。固定的小分子一般优先考虑使用碱液进行再生。
二、利用Biacore T200样品回收系统进行小分子潜在靶标回收
- 方法设置
- 打开设置方法界面,点击General Setting,选择Detection中的Multi,在Buffer setting中填写A的名称HBS-EP,其它默认(图3.1)。

图3.1 方法设置第一步:General Settings相关参数设置
- 点击Assay Steps中的New进行添加分析步骤,包括Startup(仪器预运行)、HT22 Total Lysate和PC12 Total Lysate三部分,分别选择对应的Purpose(图3),此时没有可选择的Connect to cycle type选项,需点击Cycle Types进行设置(图3.2)。
注:HT22 Total Lysate和PC12 Total Lysate两个sample选择不同的Purpose,如Sample和Control of sample,便于在确定样品位置时区分离心管的位置,避免混淆。
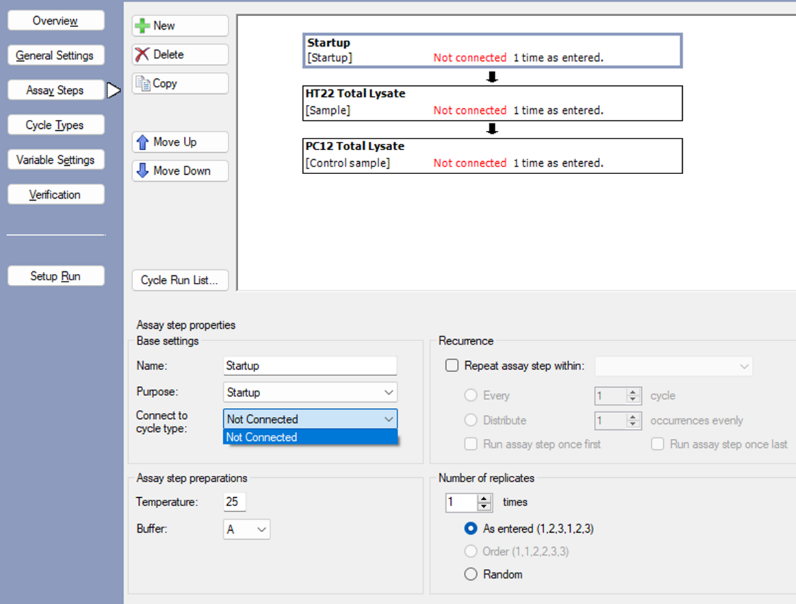
图3.2 方法设置第二步:Assay Steps设置
- 在Cycle Types界面选择New新建对应Startup、HT22 Total Lysate和PC12 Total Lysate三部分。选中Startup,在commands中选择sample,点击insert,然后设置具体的实验条件,将Sample solution设置为HBS-EP,其它默认(图3.3)。
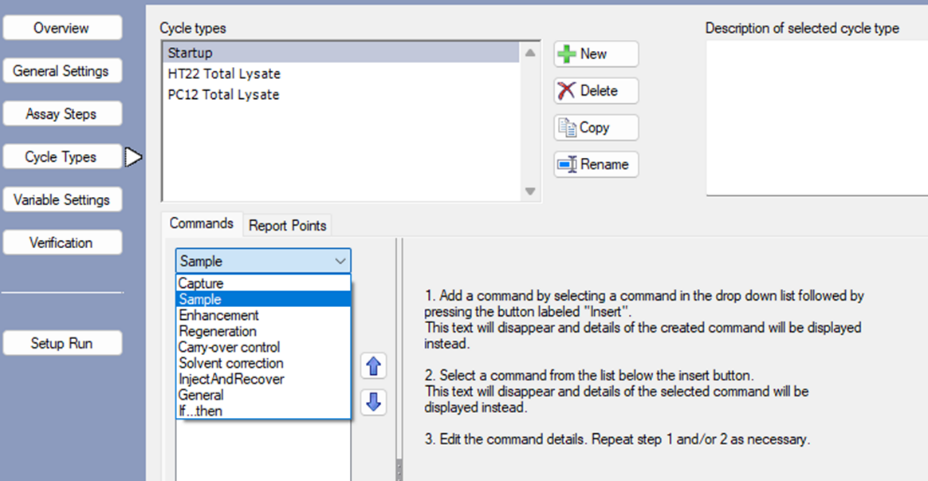
图3.3 方法设置第三步:Cycle Types设置
- 选中HT22 Total Lysate,在commands中选择Inject And Recover,点击insert,然后后选中进行具体的方法参数设置。Contact time设置为120 秒,流速设置为5 μL/min,Wash solution设置为HBS-EP,Recocery solution设置为50 mM NaOH,Incubation times设置为45秒,Deposition solution设置为150 mM Tris-HCl,pH6.0,Deposition solution volume设置为20 μL,Number of repetition设置为8其它默认。PC12 Total Lysate组别进行同样设置(图3.4)
<em>注:样品结合时间,流速以及number of repetition(重复次数)需要调整好,结合这三个条件计算总体积需要在2~100 μL范围之内,否则会出现报错:“flow rate or contact time for command 'InjectAndRecover 1' must be changed because the total required injection volume is invalid. It must be in the range 2~100”;deposition体积至少设置为20 μL,体积过小会导致无法正常回收;deposition的溶液和recovery的溶液的pH最好能中和,使得两者混合之后的pH约为7.4。</em>
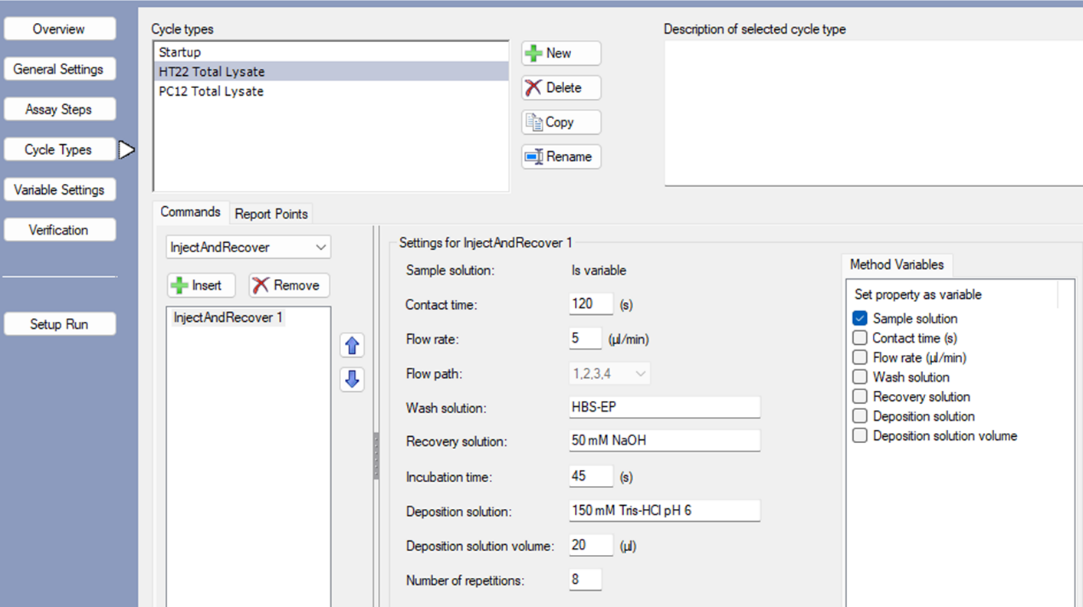
图3.4 方法设置第四步:样品回收关键程序Inject And Recover设置
- 在Assay Steps界面,点击Startup,选中Connect to cycle type中的Startup,Number of replicates设置为5 times。HT22 Total Lysate和PC12 Total Lysate选中Connect to cycle type中的对应项目即可,其它默认不变(图3.5)。
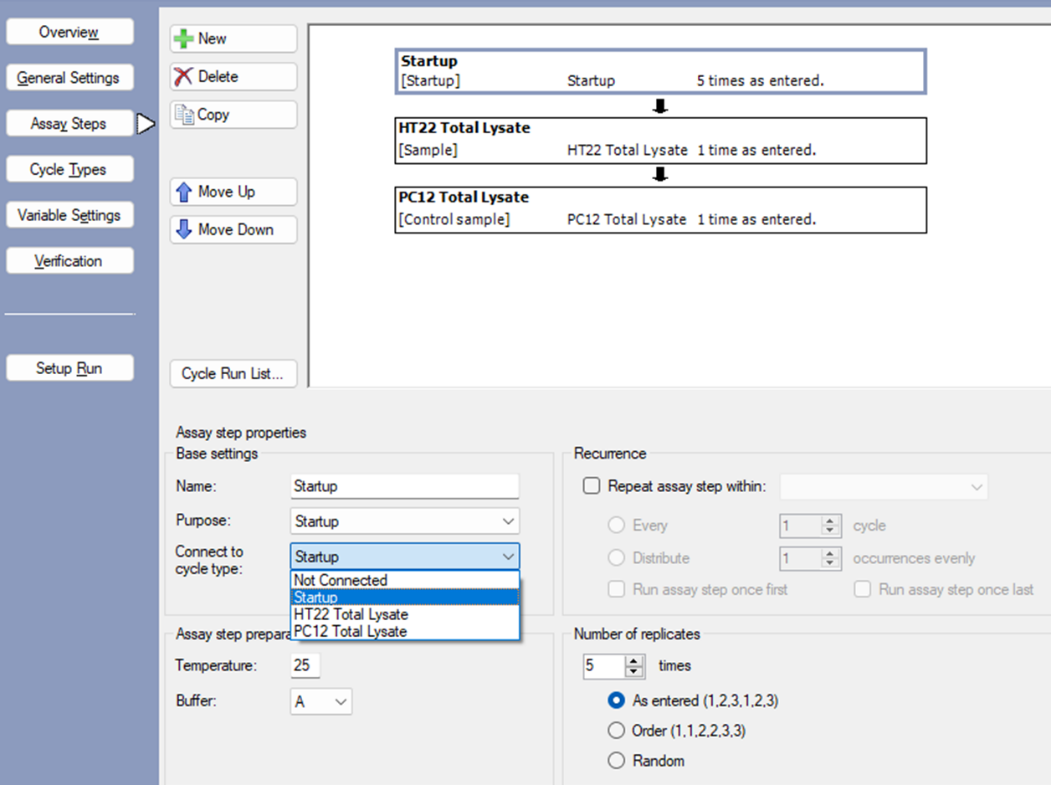
图3.5 方法设置第五步:Connect to cycle type设置
- 在Variable Settings界面,选中HT22 Total Lysate或PC12 Total Lysate,点击Define all values in method,设置样品使用的数量(图3.6)。

图3.6 方法设置第六步:Variable Settings设置
- 方法设置完成后点击verification,检查方法是否可以运行,如果没有问题会出现提示:The method has been verified and can be used to set up a run(图3.7)。
 br /> 图3.7 方法设置第七步:verification方法可以正常运行
br /> 图3.7 方法设置第七步:verification方法可以正常运行
- 点击Setup Run进行下一步,flow path选择1,2,3,4即可,然后点击next浏览整个实验的进样顺序,确保其与我们设置的分析顺序一致(图4.1;图4.2)。

图4.1 方法运行第一步:flow path的选择
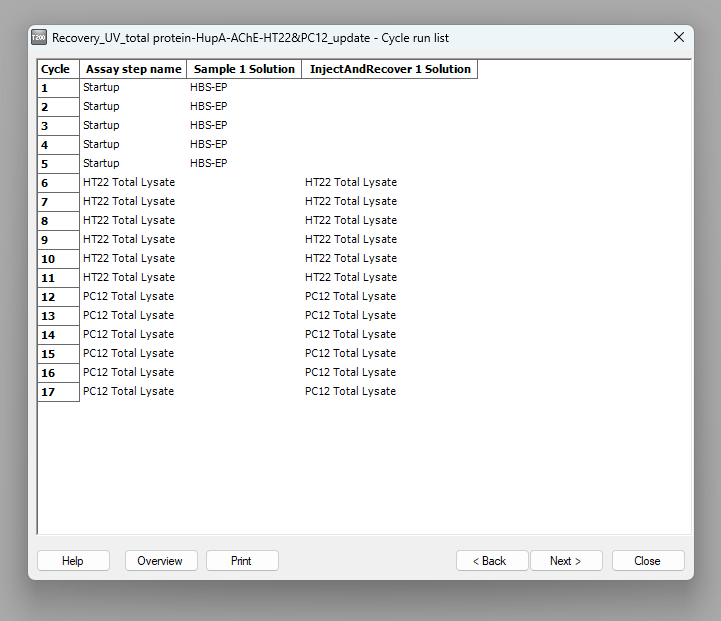
图4.2 方法运行第二步:确认样品进样顺序
- 点击next,选择Prime before run(图4.3)
图4.3 方法运行第三步:选择Prime before run
- 点击next,设置样品以及回收样品空管的位置,一般可直接使用系统的默认设置(图4.4)
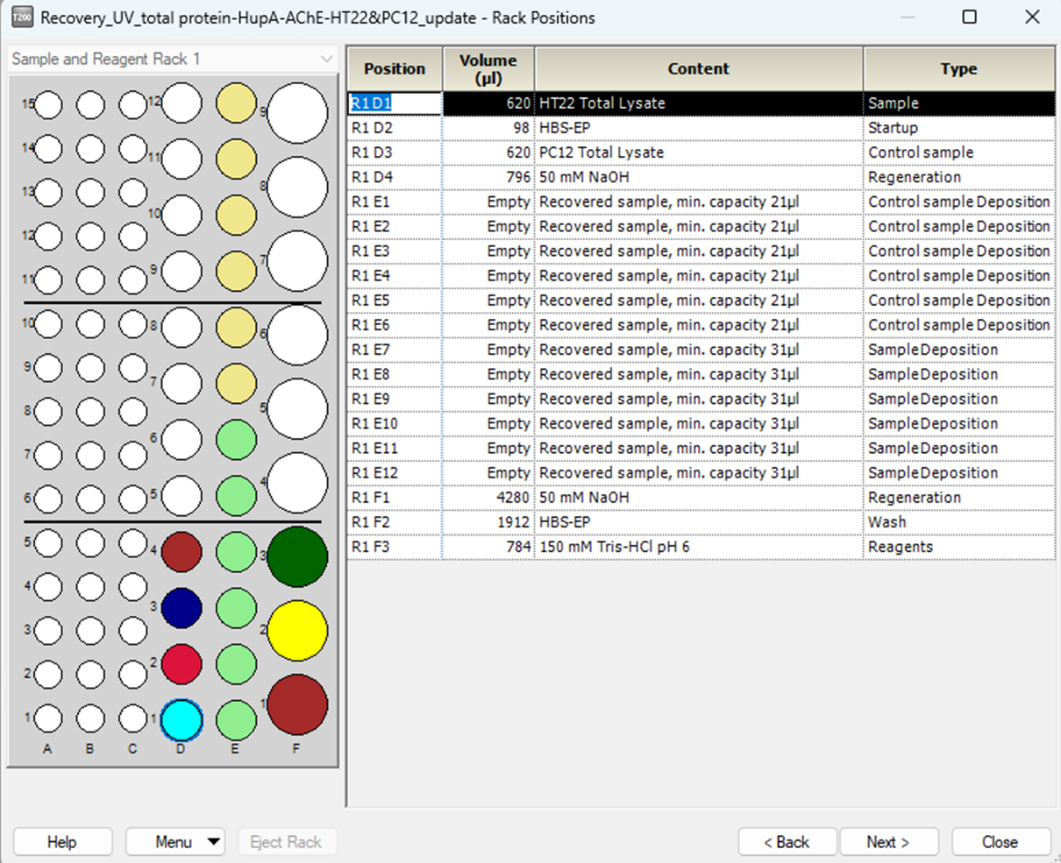
图4.4 方法运行第四步:确认样品以及回收样品空管的位置并正确放置
- 将样品放在对应位置之后点击next,根据系统提示准备对应的缓冲液,确认无误后点击Start开始运行程序(图4.5)。

图4.5 方法运行第五步:确认缓冲液的体积以及其余注意事项
- 总蛋白裂解液的回收
- 上机检测
将HT22和PC12对应的蛋白裂解液样品(1.5~2 mg/mL)稀释5倍后进行检测,观察进样后的传感曲线变化,判断结合情况以及再生情况。 - 后续检测
将回收得到的蛋白样品使用冷冻干燥机进行冷冻干燥,使用PBS 进行溶解浓缩,最后结合WB、银染实验进行AChE检测。
- 数据分析与数据解析
- 判断样品与Hup A(或Control)结合的情况。随着样品进样响应值持续升高,在进样结束后缓慢解离,之后进行短暂的系统冲洗(wash)以及使用50 mM NaOH进行再生,将与Hup A结合的蛋白回收下来,整体的基线回归正常水平。
注:在运行的过程中会突然有向下的峰出现,是由于在进行孵育,不影响整体实验,属于正常现象;再生完成后,整体水平可能会比基线低,由于碱性强,会再生掉芯片上的其它物质,不影响整体实验。 - NaOH再生之后基线回归正常水平,每个循环的变化相似,因此可以评估实验条件的合理性。
- 结合使用其它手段进行检测与分析,如WB、银染和质谱鉴定等实验,主要通过使用纯的AChE比较回收样品中条带出现的位置以及其它蛋白的情况,进行综合分析评价。
结果与数据分析
- 技术路线
本实验利用紫外照射使得Hup A以及光敏芯片产生自由基,两者接触发生共价结合从而将Hup A固定在芯片上,使用5倍稀释后的细胞裂解液进行SPR回收富集,在缓冲液冲洗之后使用NaOH将结合的蛋白回收,对回收的蛋白使用冷冻干燥机进行干燥和浓缩,之后用于银染或酶解后进行质谱检测(图5)。
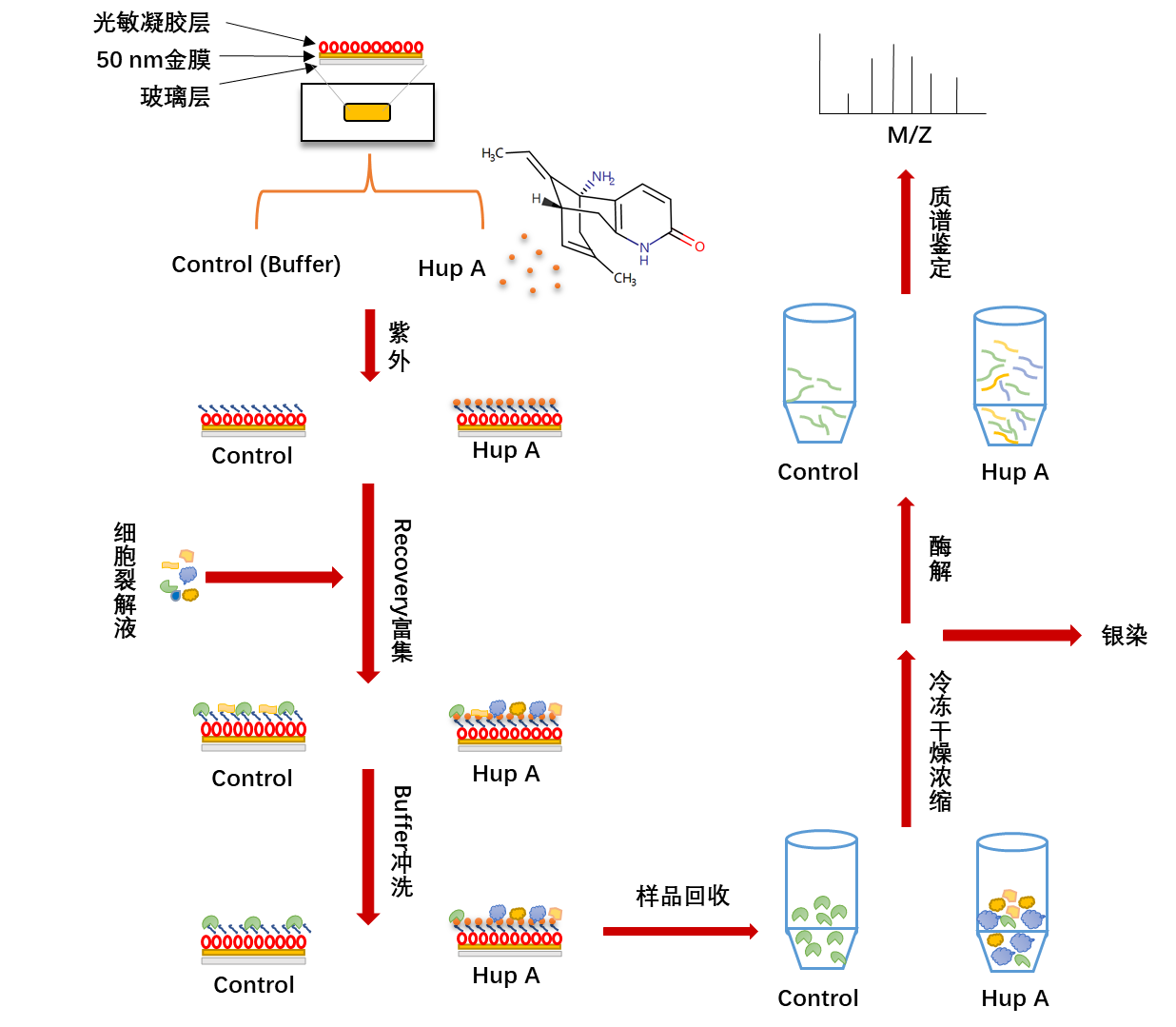
图5 技术路线
- 验证模式细胞中AChE的表达
通过资料调研发现PC12细胞[6],HT22细胞[7]的AChE含量相对高,为了进一步确定研究对象,考察HT22细胞和PC12细胞中AChE的表达情况,通过WB实验,定量30 μg,使用AChE抗体检测两种细胞中的AChE。结果显示两种细胞中均含有AChE,但蛋白的表达量均不高,低于100 ng AChE水平。为了进一步考察HT22和PC12的总蛋白裂解液中AChE的位置,使用银染和考染进行定位(图6)。结果显示在63~75 kDa之间存在和纯AChE相同位置的条带,明确两种细胞系可以用于后续样品检测。
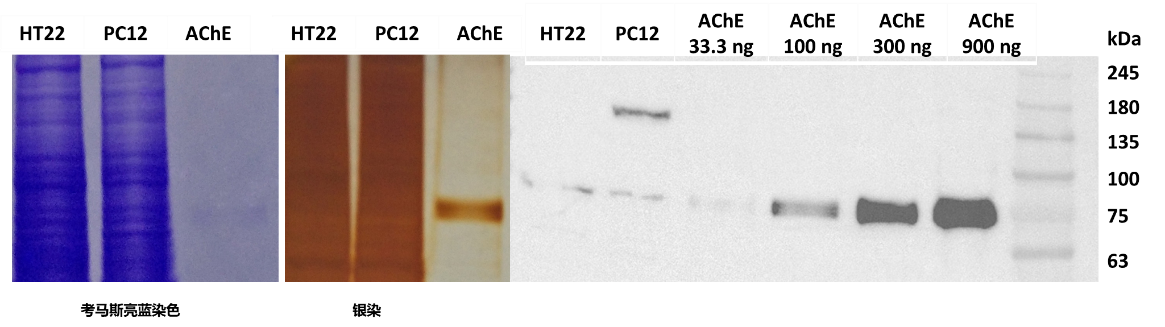
图6 AChE在HT22细胞和PC12细胞中的验证(左:考染;中:银染;右:WB)
- Hup A的固定
为了计算Hup A的固定量,将紫外处理前后的光敏芯片基线的变化与对照组进行扣减,计算得出Hup A的固定水平为186.13 RU(表1)。
表1. Hup A的固定水平
| 紫外处理前基线均值(RU) | 紫外处理后基线均值(RU) | │紫外前后差值│(RU) | Hup A固定水平(RU) |
| Hup A | 27471.98 | 26889.52 | 595.41 | 186.13 |
| NC | 27834.35 | 27425.06 | | |
- SPR样品回收程序验证
为了证明SPR 样品回收程序以及后续检测流程的合理性,使用纯的AChE (low:20 μg/mL,high:50 μg/mL两种浓度) 进行验证。AChE的结合随着浓度增加而增强,再生之后基线回归,显示该循环的样品回收正常(图7)。在所有的循环回收结束之后对回收样品进行真空冷冻干燥、浓缩,再使用银染进行检测。银染结果显示纯的AChE两个浓度都能被回收,且回收的量与浓度相关(图8)。AChE测试结果表明程序设置正常且能够正常回收蛋白用于后续的检测,具有继续探索Hup A未知靶标的可行性。
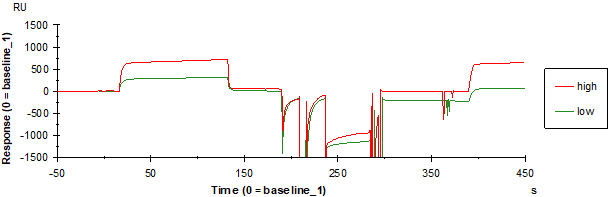
图7 高浓度和低浓度AChE回收传感图(合并)
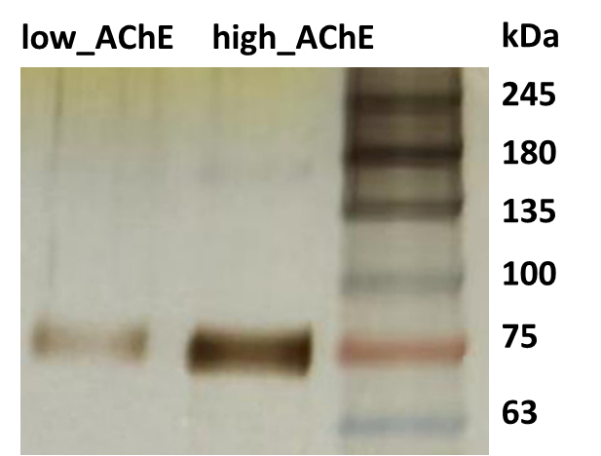
图8 AChE回收后银染鉴定结果图
- 细胞总蛋白裂解液的回收与验证
使用HT22和PC12的总蛋白裂解液进行SPR 样品回收。总蛋白裂解液与紫外固定在光敏活性芯片的Hup A结合,进样结束后整体水平比基线高,且呈现出缓慢解离的状态,再生之后基线回归,显示蛋白裂解液的样品回收正常(图9)。
为了检测总蛋白裂解液经过SPR样品回收和真空冷冻干燥浓缩之后是否含有AChE,使用WB和银染进行实验。结果显示WB未能在63~75 kDa检测出对应的AChE(约68 kDa)(图10,左),银染在相应位置存在较浅的条带(图10,右)。
研究发现差异的原因可能是WB的检测灵敏度和银染灵敏度差异所导致[8–10],但两者都可能达不到检测回收的蛋白中AChE的灵敏度,因此考虑使用灵敏度更高的质谱做进一步鉴定[11]。WB结果显示PC12蛋白裂解液中可能有类似于二聚体的存在,可能会影响检测结果,后续质谱只检测HT22的蛋白回收液。回收的样品质谱结果显示,鉴定到的蛋白中没有AChE,但是通过蛋白质量(Unique Peptides ≥ 2),丰度值(Hup A VS Ctrl Ratio ≥ 1.5)比较以及蛋白功能筛选,得到7个潜在的的备选靶标(Tubb5,Thbs1,Npm1,Jup,Fermt3,Atp5f1b,Alb)(表2)。备选靶标功能上主要与细胞骨架、细胞发育、分化、黏附、迁移、增殖、抑制程序性细胞死亡、线粒体ATP合成和核糖体功能等相关,与Hup A的神经保护、抗氧化作用、抗凋亡作用、促进细胞增殖、轴突生长的功能密切相关[12–15],后续可以此为线索进一步确认上述蛋白是否为Hup A的直接靶标。

图 9 HTT22和PC12的总蛋白裂解液回收传感图(合并)

图10 总蛋白裂解液回收结果鉴定(左:WB;右:银染)
表2 HT22细胞中Hup A潜在的作用靶标
| Accession | Gene Symbol | Unique Peptides | HupA_VS_Ctrl_Ratio | Mean_HupA | Mean_Ctrl | |
| P07724 | Alb | 2 | 121.26 | 1774667.1 | 14635.2 |
| P56480 | Atp5f1b | 3 | 1.84 | 1170437.0 | 636616.2 |
| Q8K1B8 | Fermt3 | 3 | 1.77 | 4176365.7 | 2360138.4 |
| Q02257 | Jup | 5 | 4.82 | 1308024.0 | 271284.8 |
| Q61937 | Npm1 | 2 | 1.85 | 4282350.8 | 2314211.0 |
| P35441 | Thbs1 | 2 | 3.30 | 965955.4 | 292346.6 |
| P99024 | Tubb5 | 5 | 14.26 | 68270592.3 | 4786716.9 |
失败经验
- 本次实验垂钓Hup A的靶标未能找到AChE,可能与没有加蛋白酶抑制剂导致AChE降解有关。
- 可能受限于AChE与Hup A的接触不充分,即空间位阻问题,导致AChE未与Hup A结合就被系统冲洗下来。
- 样品回收程序中分液的体积(deposition solution volume)需要估量,过少会无法回收到离心管里(1.5 mL离心管最少20 μL),导致实验失败。
- SPR回收程序回收到的样品每一管有30 μL左右,但是浓度低,为了提高后续实验检测的成功率,应尽可能多设置重复,以及将所有的回收样品浓缩成约30~50 μL体积再进行后续检测。
溶液配方
- 1× HBS-EP
量取100 mL 10× HBS-EP(100 mM HEPES,150 mM NaCl,30 mM EDTA,0.5% v/v surfactant P20)加入900 mL MQ H2O配制1× HBS-EP溶液 - Pierce® IP Lysis Buffer
25 mM Tris·HCl pH 7.4, 150 mM NaCl, 1% NP-40, 1 mM EDTA, 5% glycerol - 1× PBS
量取100 mL 10× PBS加入900 mL MQ H2O配制1× PBS溶液
致谢
感谢国家自然科学基金面上项目(82173798)的经费支持。感谢上海中医药大学交叉科学研究院王恺纯博士提供AChE活性检测方法、实验细胞以及技术上的支持。
参考文献
- Jamieson, C., Lui, C., Brocardo, M. G., Martino-Echarri, E. and Henderson, B. R. (2015). Rac1 augments Wnt signaling by stimulating β-catenin-lymphoid enhancer factor-1 complex assembly independent of β-catenin nuclear import. J Cell Sci. 128(21): 3933–3946. https://doi.org/10.1242/jcs.167742.
- Kraut, D., Goff, H., Pai, R. K., Hosea, N. A., Silman, I., Sussman, J. L., Taylor, P. and Voet, J. G. (2000). Inactivation studies of acetylcholinesterase with phenylmethylsulfonyl fluoride. Mol Pharmacol. 57(6): 1243–1248.
- 孙瑞, 高银佳 和 史海斌 (2018). 光交联技术的生物应用研究进展. 中国光学. 11(03): 444–458.
- 岳莎, 周淑如 和 郭学敏 (2014). 紫外交联合并串联亲和纯化高效鉴定蛋白复合物组分的RNA结合活性. 生物化学与生物物理进展. 41(06): 617–622.
- Jakubovska, J., Tauraitė, D. and Meškys, R. (2018). A versatile method for the UVA-induced cross-linking of acetophenone- or benzophenone-functionalized DNA. Sci Rep. 8(1): 16484. https://doi.org/10.1038/s41598-018-34892-9.
- Ma, J., Si, T., Yan, C., Li, Y., Li, Q., Lu, X. and Guo, Y. (2019). Near-Infrared Fluorescence Probe for Evaluating Acetylcholinesterase Activity in PC12 Cells and In Situ Tracing AChE Distribution in Zebrafish. ACS Sensors. 5(1): 83–92. https://doi.org/10.1021/acssensors.9b01717.
- Liu, Y. W., Zhang, L., Li, Y., Cheng, Y.Q., Zhu, X., Zhang, F. and Yin, X.-X. (2015). Activation of mTOR signaling mediates the increased expression of AChE in high glucose condition: in vitro and in vivo evidences. Mol Neurobiol. 53(7): 4972–4980. https://doi.org/10.1007/s12035-015-9425-6.
- Cohen, L. and Walt, D. R. (2018). Highly Sensitive and Multiplexed Protein Measurements. Chem Rev. 119(1): 293–321. https://doi.org/10.1021/acs.chemrev.8b00257.
- 柳荣, 黄建英 和 刘田生 (1999). 蛋白质凝胶电泳的高灵敏度染色法——复合银染. 天津农学院学报. (02): 5–10.
- Switzer, R. C., 3rd, Merril, C. R. and Shifrin, S. (1979). A highly sensitive silver stain for detecting proteins and peptides in polyacrylamide gels. Anal Biochem. 98(1): 231–237. https://doi.org/10.1016/0003-2697(79)90732-2.
- 姜山 (2019). 超高灵敏加速器质谱技术及应用进展. 质谱学报. 40(05): 401–415.
- Farooq, M. U., Min, J., Goshgarian, C. and Gorelick, P. B. (2017). Pharmacotherapy for Vascular Cognitive Impairment. CNS Drugs. 31(9): 759–776. https://doi.org/10.1007/s40263-017-0459-3.
- Friedli, M. J. and Inestrosa, N. C. (2021). Huperzine A and Its Neuroprotective Molecular Signaling in Alzheimer’s Disease. Molecule.s 26(21): 6531. https://doi.org/10.3390/molecules26216531.
- Hao, Z., Liu, M., Liu, Z. and Lv, D. (2009). Huperzine A for vascular dementia. Cochrane Database Syst Rev. (2): Cd007365. https://doi.org/10.1002/14651858.CD007365.pub2.
- Wang, J., Chen, F., Zheng, P., Deng, W., Yuan, J., Peng, B., Wang, R., Liu, W., Zhao, H., Wang, Y., et al. (2012). Huperzine A ameliorates experimental autoimmune encephalomyelitis via the suppression of T cell-mediated neuronal inflammation in mice. Exp Neurol. 236(1): 79–87. https://doi.org/10.1016/j.expneurol.2012.03.024.
Please login or register for free to view full text
View full text
Download PDF
Q&A
Copyright: © 2024 The Authors; exclusive licensee Bio-protocol LLC.
引用格式:陈锡祥, 陈红专, 徐见容. (2024). 基于SPR的活性天然产物靶点垂钓方法及其在石杉碱甲上的应用. // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011016. DOI:
10.21769/BioProtoc.1011016.
 How to cite:
How to cite: Chen, X. X., Chen, H. Z. and Xu, J. R. (2024). SPR-based Target Fishing Method for Active Natural Product Huperzine A. // Surface Plasmon Resonance (SPR) Protocol eBook.
Bio-101: e1011016. DOI:
10.21769/BioProtoc.1011016.
